Содержание
- Классификация процессов коррозии металлов
- КЛАССИФИКАЦИЯ РАЗЛИЧНЫХ ВИДОВ КОРРОЗИИ МЕТАЛЛОВ И СПЛАВОВ
- Коррозия металлов
- Презентация к уроку
- ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИИ
- Подробное руководство по видам коррозии
- Основные виды коррозии
- Химическая коррозия
- Коррозия некоторых металлов
- Способы защиты от коррозии
Классификация коррозии металлов по различным признакам
Классификация процессов коррозии металлов
Классифицировать коррозию принято по механизму, условиям протекания процесса и характеру разрушения. По механизму протекания коррозионные процессы, согласно ГОСТ 5272-68, подразделяются на два типа: электрохимическиеи химические. К электрохимической коррозии относят процесс взаимодействия металла с коррозионной средой, при котором ионизация атомов металла и восстановление окислительных агентов среды протекают не в одном акте и зависят от электронного потенциала (наличия проводников второго рода). Рассмотрим несколько видов электрохимической коррозии:
1) атмосферная– характеризует процесс в условиях влажной воздушной среды. Это наиболее распространенный вид коррозии, так как большинство конструкций эксплуатируют в атмосферных условиях. Ее можно разделить следующим образом: на открытом воздухе, с возможностью попадания на поверхность машин осадков, или с защитой от них в условиях ограниченного доступа воздуха и в замкнутом воздушном пространстве;
2) подземная– разрушение металла в почвах и грунтах. Разновидность этой коррозии – электрохимическая коррозияпод воздействием блуждающих токов. Последние возникают в грунте вблизи источников электрического тока (систем передачи электроэнергии, электрифицированных транспортных путей);
3) жидкостная коррозия, или коррозия в электролитах. Ее частным случаем является подводная коррозия– разрушение металлических конструкций, погруженных в воду. По условиям эксплуатации металлоконструкций, этот вид подразделяют на коррозию при полном и неполном погружении; при неполном погружении рассмотрен процесс коррозии по ватерлинии. Водные среды могут отличаться коррозийной активностью в зависимости от природы растворенных в них веществ (морская, речная вода, кислотные и щелочные растворы химической промышленности и т. п.). При подводной коррозии возможны процессы коррозии оборудования в неводных жидких средах, которые подразделяют на неэлектропроводящие и электропроводящие. Такие среды специфичны для химической, нефтехимической и других отраслей промышленности. К химической коррозии относят процесс, в котором окисление металла и восстановление среды представляют единый акт (отсутствие проводников второго рода). Химическая коррозия– это разрушение металлов в окислительных средах при высоких температурах. Различают два вида: газовая(т. е. окисление металла при нагреве) и коррозия в неэлектролитах:
а) характерной особенностью газовой коррозии является отсутствие влаги на поверхности металла. На скорость газовой коррозии влияет, прежде всего температура и состав газовой среды. В промышленности часто встречаются случаи этой коррозии: от разрушения деталей нагревательных печей до коррозии металла при термической обработке.
б) коррозия металлов в неэлектролитах, независимо от их природы, сводится к химической реакции между металлом и веществом. В качестве неэлектролитов используют органические жидкости.
В особую группу следует выделить виды коррозии в условиях воздействия механических напряжений (механическая коррозия). Эта группа включает: собственно коррозию под напряжением, характеризуемую разрушением металла при одновременном воздействии коррозионной среды и постоянных или переменных механических напряжений; коррозионное растрескивание– при одновременном воздействии коррозионной среды и внешних или внутренних механических напряжений растяжения с образованием транскристаллитных трещин.
Различают самостоятельные виды коррозии:
1) коррозия при трении– разрушение металла, вызываемое одновременным воздействием коррозионной среды и трения;
2) фреттинг-коррозия– разрушение при колебательном перемещении двух поверхностей относительно друг друга в условиях воздействия коррозионной среды;
3) коррозионная кавитация– разрушение при ударном воздействии среды;
4) коррозионная эрозия– при истирающем воздействии среды;
5) контактная коррозия– разрушение одного из двух металлов, находящихся в контакте и имеющих разные потенциалы в данном электролите.
Следует различать коррозию и эрозию. Эрозияо латинского слова erodere (разрушать) – постепенное механическое разрушение металла, например при истирании трущихся частей механизмов.
Самостоятельный вид коррозии – биокоррозия– это разрушение металла, при котором в качестве значимого выступает биофактор. Биоагенты– микроорганизмы (грибы, бактерии), которые являются инициаторами или стимуляторами процесса коррозии.
По характеру разрушения коррозия делится на сплошную (или общую) и местную (локальную). Сплошная коррозия охватывает всю поверхность металла, при этом она может быть равномерной или неравномерной. Местная коррозия происходит с разрушением отдельных участков поверхности металлов. Разновидность этой коррозии: точечная (питтинг), коррозия пятнами и сквозная коррозия.
Подповерхностная коррозия начинается с поверхности, но развивается преимущественно под ней таким образом, что продукты коррозии сосредоточены внутри металла. Ее разновидность – послойная коррозия, распространяющаяся преимущественно в направлении пластической деформации металла.
Структурная коррозия связана со структурной неоднородностью металла. Ее разновидность – межкристаллитная– разрушение металла по границам кристаллитов (зерен) металла; внутрикристаллитная– разрушение металла по зернам кристаллитов. Наблюдается при коррозийном растрескивании, протекающем под влиянием внешних механических нагрузок или внутренних напряжений.
Ножевая коррозия– локализованное разрушение металла в зоне сплавления сварных соединений в жидких средах с высокой коррозионной активностью.
Щелевая коррозия– усиление процесса разрушения металла в зазорах между двумя металлами.
Избирательная коррозия– разрушение одной структурной составляющей или одного компонента металла в высокоактивных средах. Существует ряд разновидностей: графитизация чугуна (растворение ферритных или перлитных составляющих) и обесцинкование (растворение цинковой составляющей) латуней.
Дата добавления: 2015-08-08 ; просмотров: 848 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
КЛАССИФИКАЦИЯ РАЗЛИЧНЫХ ВИДОВ КОРРОЗИИ МЕТАЛЛОВ И СПЛАВОВ
Различные виды процессов коррозии металлов и сплавов классифицируют по ряду признаков.
По механизму действия процессы коррозии делятся на два основных типа: химические и электрохимические.
Химическая коррозия (х.к.) — взаимодействие металла с коррозионной средой, при котором окисление металла и восстановление окислительной компоненты коррозионной среды протекают в одном акте. Это процесс коррозионного разрушения металлов и сплавов под действием сухих газов (обычно при высоких температурах), а также в контакте с некоторыми неэлектролитами. Продукты химической коррозии образуют на поверхности корродирующего металлического изделия пленки, обладающие в большинстве случаев защитным действием.
Электрохимическая коррозия (э.к.) — взаимодействие металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительной компоненты коррозионной среды протекают не в одном акте, а их скорость зависит от электродного потенциала. Это процесс коррозионного разрушения металлов и сплавов под действием влажных газов и растворов электролитов. Продукты коррозии, если они устойчивы в данной среде, образуют на поверхности корродирующего металлического изделия пленки, обладающие обычно ограниченным защитным действием.
Фреттинг-коррозия — это коррозия металлов при колебательном перемещении двух поверхностей относительно друг друга в условиях воздействия коррозионной среды. Обязательным условием протекания этого вида коррозии является присутствие кислорода, но не влаги.
Механизм фреттинг-коррозии изучен пока недостаточно. Этот вид разрушения нельзя отнести ни к химической, ни к электрохимической коррозии.
По характеру коррозионной среды различают следующие виды коррозии:
газовую коррозию (х.к.) — химическую коррозию металлов в газах при высоких температурах;
атмосферную коррозию (э.к.) — коррозию металлов в атмосфере воздуха (при наличии конденсированной пленки влаги) и атмосферных осадков;
коррозию в растворах электролитов (э.к.) — коррозию металлов при контакте металлических изделий с речной и морской водой (морская коррозия), растворами солей, кислот, щелочей;
коррозию в грунтах (э.к.) — коррозию металлов при контакте металлических изделий с грунтом — почвенным электролитом;
биологическую коррозию (э.к.) — коррозию в условиях обрастания микроорганизмами;
радиационную коррозию (э.к.) — коррозию при облучении и др.
По условиям эксплуатации металлических изделий. Некоторые виды электрохимической коррозии связаны с особыми условиями эксплуатации изделий из металлов и сплавов, особенностями конструкций, а также с действием механических факторов. Причем при эксплуатации летательных аппаратов чаще всего наблюдаются следующие виды электрохимической коррозии:
щелевая коррозия — усиление коррозии в щелях и зазорах между двумя металлами, а также в местах неплотного контакта металла с неметаллическим коррозионно-инертным материалом;
контактная коррозия — электрохимическая коррозия, вызванная контактом металлов, имеющих разные стационарные потенциалы в данном электролите;
коррозионное растрескивание — коррозия металлов при одновременном воздействии коррозионной среды и внешних или внутренних механических напряжений растяжения с образованием транскристаллитных или межкристаллитных трещин;
коррозионная усталость — понижение предела усталости металлов, возникающее при одновременном воздействии циклических растягивающих напряжений и коррозионной среды;
коррозия при трении — разрушение металлов, вызываемое одновременным воздействием коррозионной среды и трещин.
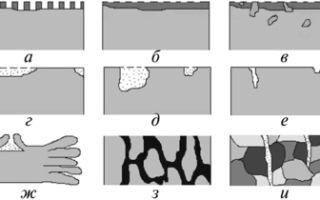
По форме коррозионных разрушений виды коррозии делят на две группы: общую и местную коррозию. Эти группы включают различные типы коррозионных разрушений (рис. 1.1).
Рис. 1.1. Характер коррозионных разрушений: общая коррозия: а — равномерная; б — неравномерная; в — структурная; местная (локальная) коррозия: г — пятнами; д — язвами; е — питтингами; ж — расслаивающая; з — межкристаллитная; и — транскристаллитная
При эксплуатации различных технических устройств в промышленности наблюдаются разнообразные формы коррозионных повреждений металлических изделий. Наиболее опасны локальные повреждения поверхности деталей, испытывающих силовую нагрузку. Развитие питтингов, являющихся концентраторами напряжения, и межкристаллитных трещин приводит к потере механических свойств металлических изделий даже при наличии ничтожного эффекта коррозии (рис. 1.2).
Рис. 1.2. Потери прочности деталей из дуралюмина при различных видах коррозионных разрушений:
- 7 — равномерная коррозия; 2 — местная коррозия;
- 3 — межкристаллитная коррозия
Коррозия металлов
Презентация к уроку
Загрузить презентацию (585,7 кБ)
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
познакомить учащихся с коррозией металлов;
Развивающие:
- развить практические умения по защите металлов от коррозии в быту;
- создать условия для развития навыков логического мышления и обобщения;
- развить умения применять ИКТ.
Воспитательные:
- научить применять свои знания на практике;
- вырабатывать у школьников познавательную активность, интерес к предмету.
Тип урока: урок изучения и первичного закрепления новых знаний.
Урок сопровождается демонстрационными опытами.
Оборудование:
Коррозия металлов (слайд№1).
В народном хозяйстве используется огромное количество металлических материалов в виде различных изделий. Но металлы и сплавы на основе металлов, приходя в соприкосновение с окружающей их средой, подвергаются разрушению. Причина этого разрушения лежит в химическом взаимодействии: металлы вступают в окислительно-восстановительные реакции с веществами, находящимися в окружающей среде, и окисляются.
Самопроизвольное разрушение металлических материалов под воздействием окружающей среды называется коррозией (слайд №2).
Проблема: Ежегодно из-за коррозии безвозвратно теряются огромные количества металла, более 20 миллионов тонн. Еще больший вред связан с порчей металлических изделий, вызываемой коррозией.
Коррозия вызывает серьезные экологические последствия. Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно воздействует на здоровье и жизнь людей. Для успешного решения этой проблемы необходимо знать механизм процессов, приводящих к разрушению металлов.
Механизм окислительно-восстановительных реакций зависит от того, в какой среде они происходят, в связи с этим различают два основных вида коррозии: химическую и электрохимическую.
3 слайд: Химическая (или газовая) коррозия– это разрушение металлов в результате их химического взаимодействия с веществами окружающей среды.
Химическая коррозия часто наблюдается в процессе обработки металлов при высоких температурах. Ей подвергаются арматура печей, детали двигателей внутреннего сгорания, аппаратура химических производств и т.д. При химической коррозии происходит взаимодействие металла с газами, находящимися в составе среды. Чаще всего это кислород. Металл окисляется, и на его поверхности образуются различные соединения:
Большинство металлов окисляется кислородом воздуха, образуя на поверхности оксидные пленки, Если эта пленка прочная, плотная, хорошо связана с металлом, то она защищает металл от дальнейшего разрушения. Такие защитные пленки появляются у Zn, Al, Cr, Ni, Sn, Pb, Nb и др. У железа она рыхлая, пористая, легко отделяется от поверхности металла и не способна защитить его от дальнейшего разрушения (слайд № 4).
Сообщение ученика: Для изготовления аппаратуры, подвергающейся газовой коррозии, применяют жаростойкие сплавы из чугуна и стали. В их состав вводят хром, кремний, алюминий; применяются также сплавы на основе никеля или кобальта. Для предотвращения коррозии, поверхность изделия, в горячем состоянии насыщают некоторыми металлами, обладающими защитным действием (например, алюминием или хромом). Таким образом, создают на поверхности защитную пленку, т.е. металл пассивируют.
Однако наибольший вред приносит электрохимическая коррозия.
5 слайд: Электрохимическая коррозия– это разрушение металлов в среде электролита с возникновением в системе электрического тока.
Как правило, металлы и сплавы неоднородны, содержат различные примеси. При их контакте с электролитами одни участки поверхности начинают выполнять роль анода, а другие роль катода. В этом случае образуется гальванический элемент, электродами которого и являются металлы, находящиеся в растворе электролита. Возникает электрохимический процесс, т.е. наряду с химическими процессами (отдача электронов), протекают и электрические (перенос электронов от одного участка к другому).
Электрохимическая коррозия протекает в присутствии влаги. Ей подвергаются подводные части судов в морской и пресной воде, паровые котлы, металлические сооружения и конструкции под водой и в атмосфере.
Проблемная ситуация: Предположим, что железные листы соединили друг с другом медными заклепками. Эта конструкция оказалась на улице большого промышленного города под дождем.
Почему произошло разрушение железного листа при контакте с медными заклепками? (слайд №6). Рассмотрим электрохимический ряд напряжений металлов (слайд №7). Все металлы по химической активности располагают в ряд, которым пользуются для предвидения результатов реакции.
При возникновении гальванической пары сила возникающего электрического
тока тем больше, чем дальше стоят металлы друг от друга в ряду напряжений. При этом поток электронов от более активного металла идет к менее активному металлу. Более активный металл (железо), расположенный в ряду напряжений левее, будет разрушаться (т.к. является анодом), предохраняя тем самым менее активный металл от коррозии (медь).
Коррозионные процессы весьма разнообразны, рассмотрим их протекание в различных средах электролита (слайд №8).
В кислотной среде атомы железа отдают электроны, которые переходят к меди и на ее поверхности соединяются с ионами водорода, выделившимися из компонентов среды. На катоде идет процесс восстановления ионов водорода с образованием газообразного водорода.
В щелочной или нейтральной среде идет восстановление кислорода, растворенного в воде с образованием OH — . Далее катионы железа и гидроксид-ионы соединяются с образованием неустойчивого гидроксида железа (II), который далее окисляется до оксида железа (III).
При использовании металлических материалов очень важен вопрос о скорости их коррозии. От чего зависит скорость коррозии? (слайд №9).
Перед вами 5 пронумерованных стаканов.
В 1-ом стакане железный гвоздь находится в воде.
Во 2-ом стакане железный гвоздь в растворе хлорида натрия.
В 3-ем стакане к железному гвоздю прикрепили медную проволоку и они находятся в растворе хлорида натрия.
В 4-м стакане железный гвоздь находится в контакте с цинком, и они помещены в раствор хлорида натрия.
В 5-ом стакане железный гвоздь находится в растворах хлорида и гидроксида натрия.
Давайте сравним полученные результаты и объясним результаты эксперимента (демонстрация приготовленного за несколько дней опыта по коррозии).
Проблема: Почему в одних случаях коррозия усиливается, а в других замедляется? Объясните процессы, происходящие в каждом стакане.
В стакане №1 – железо прокорродировало слабо, в чистой воде коррозия идет медленно. Мы наблюдаем химическую коррозию.
В стакане №2 – идет химическая коррозия, но здесь скорость коррозии выше, чем в 1-ом стакане, следовательно, хлорид натрия – увеличивает скорость коррозии.
В стакане №3– мы наблюдаем электрохимическую коррозию (железо находится в контакте с медью). Скорость коррозии высока, т.к. раствор хлорида натрия – сильный электролит.
Суммарное уравнение: Fe 0 + 2H + Fe 2+ + H2 0
В стакане №4– также идет коррозия, но не железа, а цинка, т.к. железо менее активный металл является катодом, а цинк анодом:
В стакане №5 – железо практически не подвергается коррозии, следовательно, гидроксид натрия – замедляет коррозию, гидроксид-ионы являются ингибиторами, т.е. замедляют коррозию.
Вывод: Катионы водорода и растворенный в воде кислород – важнейшие окислители, вызывающие электрохимическую коррозию. Скорость коррозии тем больше, чем сильнее отличаются металлы по своей активности (т.е. чем дальше друг от друга они расположены в ряду напряжений металлов).
Для предупреждения коррозии и защиты от нее применяются разнообразные методы (слайд №10).
- Неметаллические – неокисляющиеся масла, специальные лаки, краски, эмали.
- Химические – искусственно создаваемые поверхностные пленки: оксидные, нитратные, фосфатные, полимерные и другие. Например, железо пассивируют погружением в концентрированную азотную кислоту.
- Полимерные покрытия изготавливают из полиэтилена, полихлорвинила, полиамидных смол. Наносят их двумя способами: нагретое изделие помещают в порошок полимера, который плавится и приваривается к металлу, или поверхность металла обрабатывают раствором полимера в низкокипящем растворителе, который быстро испаряется, а полимерная пленка остается на изделии.
- Металлические.
Сообщение ученика: В качестве металлов для покрытия обычно применяют металлы, образующие на своей поверхности защитные пленки. К таким металлам относятся хром, никель, цинк, кадмий, алюминий, олово и некоторые другие. Реже применяются металлы, имеющие высокий электродный потенциал – серебро, золото. Чаще всего металлические покрытия наносят с помощью гальванотехники.
Никелевые покрытия нарядны, стойки, прочны. Поэтому никелирование – самый распространенный в гальванотехнике процесс.
- Протекторная (анодная) – к защищаемой металлической конструкции, присоединяют кусок более активного металла (протектор), который служит анодом и разрушается в присутствии электролита, В качестве протектора при защите корпусов судов, трубопроводов, кабелей и других металлических изделий используют магний, алюминий, цинк.
- Катодная – металлоконструкцию подсоединяют к катоду внешнего источника тока. Происходит электрозащита – нейтрализация тока, возникающего при коррозии, постоянным током, пропускаемым в противоположном направлении.
5.Подавление влияния коррозионной среды.
- Введение веществ – ингибиторов, замедляющих коррозию (нитрит натрия, хромат и дихромат калия, фосфаты натрия и другие). Защитное действие этих веществ обусловлено тем, что они адсорбируются на поверхности металла и каталитически снижают скорость коррозии, а некоторые из них (хроматы и дихроматы) переводят металл в пассивное состояние.
- Удаление растворенного в воде кислорода (деаэрация).
Таким образом, металлы и сплавы можно защищать от коррозии двумя способами: изоляцией поверхности металла от среды и искусственным повышением коррозионной стойкости путем замедления процессов коррозии.
Наиболее распространенные типы и виды коррозии можно представить с помощью схемы (слайд № 11).
Для закрепления материала ответьте на следующие вопросы:
- Какой вид коррозии приносит больший вред?
- Почему луженый бак в местах повреждения быстро ржавеет, а оцинкованный при тех же условиях не разрушается?
- Почему считают, что рядом со стальной коронкой не рекомендуется ставить золотую?
ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИИ
Коррозия — процесс разрушения металлов при химическом или электрохимическом воздействии окружающей среды. Это самопроизвольный процесс, связанный с переходом системы металл — среда в более термодинамически устойчивое состояние, поэтому его протекание можно контролировать по изменению поверхностной энергии Гиббса. Особенность коррозии — ее гетерогенный характер. Она вызывается воздействием на металл жидких или газообразных продуктов и, как любой гетерогенный процесс, начинается с поверхности раздела фаз. Наиболее распространены и уязвимы в коррозионном отношении черные металлы, однако большое внимание приходится уделять защите цветных и даже редких металлов.
Рис. 5.1. Виды коррозии (по типу разрушений):
1 — равномерная; 2 — неравномерная; 3 — язвенная; 4 — Точечная; 5 — подповерхностная; 6 — межкристаллит — ная
Коррозию классифицируют по разным признакам: типу, условиям протекания, виду коррозионных разрушений. По типу происходящих процессов различают Химическую и Электрохимическую коррозию. Первый вид коррозии имеет место в неэлектролитах и сухих газах и подчиняется законам химической кинетики гетерогенных процессов. Она не сопровождается образованием электрического тока. Электрохимическая коррозия протекает в растворах электролитов и во влажных газах и характеризуется наличием двух параллельно идущих процессов — окисления и восстановления. Этот вид коррозии сопровождается направленным перемещением электронов в металле и ионов в электролите, т. е. возникновением электрического тока.
По условиям протекания процесса, которые весьма разнообразны, различают Газовую, Атмосферную, Жидкостную, Почвенную, Биологическую коррозию.
Наибольший вред приносит атмосферная коррозия. Она протекает под влиянием кислорода воздуха и влаги с растворенными в ней химическими веществами.
По виду коррозионных разрушений коррозию подразделяют на Равномерную и НеравномернуЮу язвенную, Точечную (питтинговую), щелевую, Подповерхностную, Межкристаллитную (рис. 5.1). Первые два вида разрушений относятся к общей, или сплошной, коррозии, остальные — к местной. При одновременном воздействии среды и механических нагрузок возможно коррозионное растрескивание; в металле появляются трещины транскристаллитного характера, которые, прорастая, нередко приводят к полному разрушению изделий.
5.1.2. ПАССИВНОСТЬ МЕТАЛЛОВ
В нормальном состоянии большинство металлов содержит на поверхности оксидные пленки, которые возникают в результате адсорбции кислорода из воздуха:
Ме + 02 —► Ме 120адс.
Адсорбированный кислород может вступать в химическое взаимодействие с металлом с образованием неактивного поверхностного
Слоя, который придает ему адсорбционную пассивность. Пассивность металлов — состояние относительно высокой коррозионной стойкости, вызванное торможением анодного процесса электрохимической коррозии. Такое состояние характеризуется: 1) резким уменьшением скорости коррозии, которая обычно постоянна во времени, и 2) значительным смещением потенциала металла в положительную сторону, например для железа от -0,2 до +1,0 В, для хрома от -0,4 до +0,9 В.
Существует ряд теорий, объясняющих пассивное состояние металлов: пленочная, адсорбционная, кинетическая, электронных конфигураций.
Пленочная теория объясняет пассивное состояние металлов образованием тончайшей (порядка 10-10—10-8 м) защитной фазовой пленки. Это сплошная, бесцветная стекловидная пленка оксида, отличающаяся хорошей электронной, но плохой ионной проводимостью.
Согласно Адсорбционной теории пассивное состояние достигается образованием на поверхности металла слоя из адсорбированного кислорода толщиной 5-10 нм. Адсорбированный кислород насыщает валентности наиболее активных поверхностных атомов металла и снижает его поверхностную энергию. Изменение энергии поверхности при полном ее покрытии адсорбированным монослоем составляет 3,8 • 10”12 эрг на электрон, что соответствует 2,37 эВ.
Кинетическая теория связывает явление пассивности с затруднениями в протекании анодного процесса растворения металла вследствие образования в поверхностном слое устойчивого твердого раствора металл — кислород.
Согласно Теории электронных конфигураций возникновение пассивного состояния — результат неукомплектованности электронами внутренних оболочек металлов, имеющих незаполненные ^-уровни. Неукомплектованность возникает вследствие химической адсорбции кислорода или другого окислителя, которая сопровождается поглощением электронов, понижением их плотности в поверхностных слоях металла. Установлено, что способность оксидного слоя пассивировать металлы зависит от его полупроводниковых свойств.
Указанные теории пассивности относятся к металлам, находящимся в кристаллическом состоянии. В настоящее время получены металлы, в том числе железо, имеющие аморфное строение, пассивность которых значительно выше, чем кристаллических.
Пассивный слой на черных металлах создается в основном за счет оксидов Ре203, Ре304 и РеО • ОН. Защитными свойствами могут обладать только сплошные оксидные слои. Условием сплошности является превышение объема оксида Уок над объемом металла УМе,
Из которого он получен. Пассивируются в основном поливалентные металлы, для которых соблюдается условие:
Для щелочных и щелочноземельных металлов, за исключением бериллия, это условие не выполняется и пассивация не проявляется. В пассивное состояние металлы могут быть переведены не только в результате взаимодействия с кислородом воздуха, но и при активированной адсорбции (хемосорбции) ионов, в первую очередь таких анионов, как NO3, N02, CrO^-, WO4”, а также при воздействии на металл электрического тока в среде электролитов.
Пассивность оказывает определяющее влияние на коррозионное поведение металлов. Достаточно отметить, что высокая коррозионная стойкость ряда металлов, например титана, обусловлена исключительно их пассивностью. Большинство металлов, способных к са — мопассивации, хорошо сохраняются в атмосфере невысокой влажности (иногда до 40-70 %). Коррозия наступает лишь тогда, когда равновесие нарушается и происходит изменение фазового или химического состава пассивного слоя.
Подробное руководство по видам коррозии
Коррозией называют самопроизвольную деструкцию металлов под влиянием факторов окружающей среды в её химическом или физико-химическом выражении. В более широком понимании можно утверждать, что кроме металлов коррозии также подвержены иные материалы: пластмасса, каучук, керамические изделия, бетоносодержащие смеси и т.д. Виды коррозии поделены с учетом основного фактора, однако они могут пересекаться.
Несложно понять, что такое коррозия, ведь примеров вокруг более, чем достаточно. Степень коррозии может быть выражена в прямых и побочных убытках.
К побочным причисляют убытки из-за отказа оборудования, пришедшего в недееспособное состояние в коррозионной среде, временного простоя, потери времени на замену деталей и ремонт, порчи товаров параллельных производств по причине загрязнения продукции видимыми последствиями коррозии, дополнительных затрат на электроэнергию, воду и ресурсы.
Прямыми убытками исчисляют испорченные трубопроводы, машины и оборудование.
Основные виды коррозии
Коррозионные процессы классифицируют по нескольким параметрам, а конкретные типы коррозии различают по некоторым признакам. Ниже вы узнаете, по каким факторам классифицируют коррозию, и что такое, например, химическая коррозия.
Классификация по механизму протекания процессов
Химическая коррозия – процесс контакта элемента металла со средой, способствующей развитию коррозии, во время которого реакция окисления металлического элемента и восстановления самой окислительной компоненты среды происходит одновременно.
Химическая коррозия – это когда продукты реакции не сепарированы в пространстве.
Электрохимическая коррозия – механизм реакционного соприкосновения раствора электролита с металлом, сущность которого, в противовес химическому типу ржавления, заключается в процессе, когда атомы металла ионизируются, окислительная компонента среды восстанавливается не в едином пространственном и временном промежутке: скорость реакций обусловлена электродным потенциалом.
Классификация по виду коррозионной среды и условиям
Газовая коррозия – реакция ржавления металлов в условиях газовой среды с минимально допустимым содержанием воды (коэффициент не выше 0,1%) либо с применением экстремально высоких температур. Газовая коррозия популярна в промышленных сферах: нефтехимической, а также химической отраслях.
Пример: вычленение «хлеба» химической промышленности – серной кислоты — путем проведения реакции окисления диоксида элемента; расщеплении нефти с целью получения производных меньшей молекулярной массы.
Подземная коррозия – ржавление в грунтовой среде.
Атмосферная коррозия — ржавление металлов в воздухе либо влажном газе.
Биокоррозия – реакция с появлением ржи под воздействием микроорганизмов.
Контактная коррозия – при подобной реакции участвует несколько металлов с отличными друг от друга потенциалами по электролиту.
Радиационная коррозия – возникновение ржи под влиянием радиоактивных лучей.
Коррозия током – процесс коррозии происходит в условиях воздействия внешнего либо блуждающего тока.
Коррозия под напряжением – ржавление металла в коррозионной среде под механическим напряжением. Химия подобного вида ржи небезопасна, в главной мере для опорных конструкций с воздействием механических нагрузок на них (турбины, рессоры, ведущие оси строений). Немаловажным нюансом при обозначенном типе ржавления служит потенциальная коррозионная усталость – накопительный эффект возникает при периодичном растягивающем напряжении.
Схожее цикличное ржавление свойственно валкам прокатных станов, рессорам автомобилей и аналогичным конструкциям.
Коррозионная кавитация – разрушительное влияние на металл коррозионной среды и ударной силы.
Фреттинг-коррозия – разрушение металлических поверхностей единовременным воздействием благоприятной для ржи среди и вибрации. По проявлению результатов процесса ликвидировать следствие возможно, для этого потребуется четко подобрать структурный материал, снизить уровень трения, применить покрывающую пленку либо выполнить другие подходящие в таком случае действия.
Межкристаллитная коррозия – проявление ржи по граням вкраплений. Так называемое скрытный разлом, в период активности которого внешних признаков не заметно, однако металл в краткие сроки лишается свойств прочности и эластичности. Наиболее часто от подобного вида внешнего вмешательства страдают сплавы, в состав которых входят никель, алюминий, хром.
Щелевая коррозия – является причиной повреждения металла в резьбовых креплениях, между прокладками и аналогичных участках.
На видео: всё о электрохимической коррозии.
Классификация по типу коррозионной деструкции
Сплошная коррозия – ржавчине подвергается поверхность целиком. Различают несколько подтипов:
- Равномерная (поверхностная коррозия) – ржа проявляется одновременно по захваченной процессом территории. Пример – разрушение железных труб на открытом воздухе.
- Неравномерная – скорость реакций на отдельных участках общей территории варьируется.
Избирательная коррозия — ржавеет один из компонентов сплавов или обособленная структурная секция (например, реакция обесцинкования латуни).
Местная коррозия — разрушению подвергаются сепаратные пятна целостного объекта. Проявление наблюдается в форме отдельных вкраплений поврежденностей, проникнувших на малую глубину слоя металла (ржа по латуни в соленой морской воде); значительных углублений в виде раковин (сталь, закопанная в почву); обособленных точек, именуемых питтингами, входящих в толщу металла на серьезную глубину (хромовоникелевая сталь аустенитного класса).
Химическая коррозия
Химическая коррозия возможна по причине термодинамической нестабильности металлов. Газовая коррозия, имея собственное определение, — разновидность химической. Последние имеют возможность самостоятельно преобразовываться в значительно устойчивее состояние по окончанию реакции: металл + окислитель → продукт реакции.
Наиболее часто встречающийся пример химической коррозии металла – реакция с кислородом:
Обезуглероживание стали как газовая коррозия:
Коррозия некоторых металлов
Коррозия меди
Одним из ключевых химических элементов для отечественной промышленности является медь. Металл также подвержен деструкции, как и другие металлические поверхности, хотя медь больше защищена от коррозии.
Коррозия меди — разрушение последней в результате воздействия коррозионной среды.
Даже столь стойкий к разрушениям элемент подвержен негативным изменениям при воздействии окружающей среды. Коррозия меди имеет высокий показатель ухудшения свойств металла в аэрированных растворах, содержащих ионы, образовывающие комплексы с красным металлом, окислительных кислотах.
Медь стабильна в следующих условиях:
- в атмосферной среде;
- в морской и пресной водах;
- контактируя с галогенами в специальных условиях;
- в кислотах-неокислителях, слабых растворах Н3РО4, Н2SO4.
Медь нестабильна в следующих условиях:
- в ряде соединений серы, в том числе сероводороде, чистой сере;
- в кислотах-окислителях, аэрированной неокислительной среде, концентрате Н2SO4, например:
- растворах солей-окислителей тяжелых металлов, как то Fe2(SO4)3, FeCl3;
- агрессивной воды, аэрированной воды;
- амина, NH4OH.
Атмосферная коррозия меди:
Коррозия железа
Еще один распространенный элемент, подверженный ржавлению от коррозии – железо. Наибольший процент реакций по возникновению ржи на железе припадает на реакции по его окислению воздухом или кислотами из растворов.
При химической коррозии электроны переходят на окислитель, окисление металлов показано наглядно:
Электрохимическая коррозия протекает в условиях токовой проводимости. Пример атмосферной и грунтовой реакции:
Способы защиты от коррозии
Разработки в сфере коррозионной протекции
Рассмотрев, какие виды коррозии существуют, стоит описать, бывают ли орудия против них. Исследования в области защиты от коррозионных процессов проводятся на постоянной основе. На сегодняшний день самыми популярными методами борьбы против разрушителя металлической поверхности являются:
- Защитное покрытие.
- Воздействие на коррозионную среду с понижением активности среды (лишение коррозионной среды кислорода, использование ингибиторов процесса).
- Протекция электрохимического направления.
- Инновационная разработка и внедрение в производство новейших структурных материалов с повышенной устойчивостью к процессу разрушения. Суть метода заключается в вычленении из металлических сплавов добавок, которые катализируют разрушительный процесс (например, удаление из сплавов алюминия примеси железа, из сплавов железа – серы), либо прямопротивоположном процессе – внедрении в существующий сплав дополнительных элементов, передающих свою коррозионную устойчивость всему сплаву(к примеру, добавление хрома или никеля в сплав железа, усиление магниевых сплавов марганцем и т.п.).
- Использование в строительстве неметаллических компонентов, где это представляется возможным (высокополимерного пластика, стекла и керамики).
- Минимизация воздействия неблагоприятных условий на металл (отделение металлических конструкций от внешней среды, скорейший ремонт на участках скопления воды, удаление прощелин в цельных конструкциях).
Защитная пленка как преграда разрушению
Высокоустойчивые самостоятельные химические элементы используют в виде покрытий для возникновения на поверхности изделий оксидной плёнки: Zn, Ni, Cr, Ag и Au.
Коррозия металлов не может проникнуть внутрь металлического изделия без внешних повреждений. На конструкции наносят покрытия – это и служит как специфическая защита. Ряд металлов известны нам по своей ценности в сфере ювелирного дела, так подобные пленки выполняют не только защитную функцию, но и эстетическую.
Металлические покрытия в свою очередь делятся на анодные и катодные. Анодные пленки выполняются из металла активнее, нежели внутренний защищаемый сплав. Катодные же, наоборот, выполнены из металла менее активного, и не направлены на протекцию нижнего слоя металл в случае видимых повреждений.
Неметаллические пленки так же разделены на 2 подвида: неорганические (эмали) и органические (лаки, краски, резина, битум).
Как бороться с коррозией (2 видео)