Содержание
- Получение меди
- Способы получения меди
- Получение меди электролизом
- Получение оксида меди
- Получение сульфата меди
- Получение хлорида меди
- Получение глицерата меди
- Получение нитрата меди
- Получение сульфида меди
- Производство меди
- Способы производства меди
- Стадии пирометаллургического производства меди
- Производство меди в России и мире
- Производство меди
- Подготовка руд к плавке
- Плавку на штейн
- Конвертирование штейна
- Рафинирование меди.
- Лекция 7. Гидрометаллургия меди.
- Гидрометаллургическая переработка медных руд
Гидрометаллургический способ получения меди
Получение меди
Медь или купрум, названа так в честь острова Кипр, где нашли крупное ее месторождение. Это один из первых металлов, освоенных человеком. Медный век – удивительная эпоха, в которую обиход человека был наполнен медными орудиями и предметами быта, он продолжался с IV до III тысячелетия до н. э.
Способы получения меди
Для извлечения меди из минералов и руд, в которых она находится, на сегодняшний день используют три метода:
- гидрометаллургический
- пирометаллургичекий
- электролиз.
Получение меди пирометаллургическим методом является наиболее распространенным. Сырьем для этого процесса выступает халькопирит. Чтобы получить из халькопирита чистую медь, необходимо осуществить ряд операций. Первая, из которых, заключается в обогащении медной руды, методом окислительного обжига или флотации.
В основе флотации лежит тот факт, что пустая порода и ее медесодержащие части, смачиваются по-разному. Если поместить всю массу породы в емкость с жидким составом, в котором имеются воздушные пузырьки, то часть с минеральными элементами, перемещается при помощи этих пузырьков на поверхность, и прилипает к ним. В результате на поверхности ванны наблюдается наличие концентрата или черновой меди. В этом составе присутствует от 10 до 35% чистой меди. Этот порошкообразный концентрат является сырьем для дальнейшего получения чистой меди.
Совсем по-другому протекают реакции получения меди методом окислительного обжига. Этим методом обогащают медные руды, в составе которых имеется существенное количество серы. Для реализации этой технологии необходимо нагреть руду до температуры 700–8000 градусов. Под действием таких высоких температур происходит окисление сульфидов, и объем серы в медной руде снижается почти в два раза. Следующим этапом является расплавление обогащенной руды в отражательных или шахтных печах при температуре 14500. Результатом этого расплава является образование штейна – сплава, который состоит из сульфидов меди и железа.
Чтобы улучшить показатели штейна его подвергают обдуванию в горизонтальных конвертерах без добавления дополнительного топлива. Таким образом, железо и сульфиды окисляются, оксид железа превращается в шлак, а сера становится оксидом – SO2.
Черновая медь, полученная таким способом, имеет в своем составе около 91% меди. Для дополнительной очистки металла выполняется рафинирование меди, то есть удаление посторонних примесей. Это осуществляется благодаря технологии огневого рафинирования в присутствии подкисленного раствора медного купороса. Это рафинирование меди носит электролитический характер, и дает возможность получить металл с чистотой 99,9%.
Гидрометаллургический метод обогащения меди основан на процессе выщелачивания металла с помощью серной кислоты. Результатом такого процесса является получение раствора, из которого в дальнейшем выделяют чистую медь. Также этот метод подходит для выделения драгоценных металлов. Эту технологию применяют для обогащения руд, в которых присутствует крайне малое количество меди.
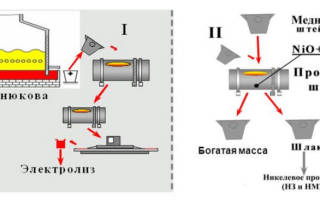
Получение меди электролизом
Электролиз меди является одним этапов химико-физических процессов, которому подвергают руду, чтобы получить медь. Примечательно, что для получения 1 тонны чистой меди, потребуется переработать как минимум 200 тонн медной руды.
Сама процедура обработки медной руды – это многоступенчатый и очень сложный процесс, который состоит из 7 стадий. Самой последней и является электролиз меди.
Руду после добычи необходимо измельчить в особых машинах. Далее происходит процесс флотации, в результате которого, как мы знаем, формируется концентрат с сохранением минералов меди. После этого происходит обжиг при высоких температурах в специальных печах. Шихту, полученную в процессе обжига, помещают в печь для плавки, где она становится штейном, который в свою очередь оправляют на конвертирование. Продукт, полученный после этих процессов, называют черновой медью, где 2-3% объема занимают примеси. В качестве примесей выступают цинк, железо, или сера. Их удаляют реакцией окисления. На этом этапе образуется «красная» медь, в которой присутствует 99,7-99,9% Cu. Последним этапом является непосредственно электролиз меди, который позволяет добиться получения максимально чистой меди.
Чтобы осуществить процесс электролиза меди понадобится специальное оборудование, а именно емкости, которые заполняют водным раствором сульфата меди с содержанием свободной серной кислоты. В результате проведения электролиза, мы получим осадок чистой меди на катодах. А все, что окажется на дне ванны, принято называть шламом. Он является сырьем для получения благородных металлов.
Получение оксида меди
Оксид меди (II) CuO представляет собой кристаллы черного цвета, которые подвергаются кристаллизации в моноклинной сингонии. Плотность соединения составляет 6,51 г/см3, а плавится он при температуре 1447°С в условиях высокого давления. В результате нагревания до 1100°С является выделение оксида меди (I):
В воде оксид меди не растворяется и не вступает в реакции с ней. Обладает слабыми амфотерными свойствами с преобладанием основных.
С водными растворами аммиака реагирует с образованием гидроксида тетраамминмеди (II):
Также легко вступает в реакции с разбавленными кислотами с выделением соли и воды:
Результатом сплавления оксида меди со щелочами является образование купратов:
Чистую медь из оксида можно получить методом восстановления водородом, угарным газом и активными металлами:
Реакция получения оксида меди методом прокаливания гидроксида меди (II) при температуре 200°С:
Также получить оксид меди можно в процессе окисления металлической меди на воздухе при температуре 400–500°С:
Получение сульфата меди
Получить сульфат меди можно тремя реакциями:
растворить CuO в H2SO4
в присутствии концентрированной серной кислоты с медью, обязательно при нагревании
методом взаимодействия Cu2O с разбавленной серной кислотой
Получение хлорида меди
В природе хлорид меди находится в составе очень редкого минерала эрнохальцита CuCl₂•2H₂O, который представляет собой кристаллы синего цвета.
Двухвалентный хлорид меди обладает важным практическим значением, и добычи его только лишь из природного минерала очень мало. Поэтому ученые придумали несколько способов искусственного получения данного соединения.
Главной реакцией промышленного синтеза CuCl₂ можно назвать реакцию хлорирования сульфида меди в условиях высокой температуры от 300 до 400 градусов °С. Выглядит реакция так
Еще одним вариантом синтеза хлорида двухвалентной меди является хлорирующий обжиг, который осуществляется при температуре более 500 С:
- CuS + 2NaCl + 2O₂ ―› CuCl₂ + Na₂SO₄
Обе реакции нуждаются в использовании специализированного оборудования и соблюдении повышенных мер безопасности, по этой причине данные реакции можно проводить только в условиях промышленного производства. В лабораторных условиях также можно получить хлорид меди следующими реакциями
- Cu + Cl₂ ―› CuCl₂
- CuO + 2HCl ―› CuCl₂ +H₂O
- Cu(OH)₂ + 2HCl ―› CuCl₂ + 2H₂O. Реакция нейтрализации
- CuCO₃ + 2HCL ―› CuCl₂ + H₂O + CO₂. В результате этой реакции более сильная кислота вытеснит кислотный остаток более слабой кислоты. Протекает реакция замещения
- 3Сu + 2HNO₃ + 6HCl ―› 3CuCl₂ + 2NO +4H₂0. Эта реакция является наиболее оригинальной. Она протекает только в присутствии смеси двух сильных кислот.
Получение глицерата меди
Качественная реакция для выявления присутствия глицерина в растворах осуществляется в присутствии сульфата меди (II) и раствора гидроксида натрия. В результате реакции образуется глицерат меди – комплексное соединение сине-василькового оттенка.
Химическую реакцию проводят следующим образом:
- к раствору сульфата меди (II) приливают раствор гидроксида натрия, в результате чего происходит окрашивание раствора в синий цвет. Таким образом, наблюдаем выпадения осадка гидроксида меди (II)
- после этого добавляем несколько мл глицерина и перемешиваем раствор. Образовавшийся осадок растворяется с образованием комплексного соединения оттенка индиго. Это и есть глицерат меди.
Получение нитрата меди
Получение нитрата меди Cu(NO3)2 довольно увлекательное занятие. А также очень полезное, поскольку он является довольно популярным красителем. Нитрат меди (II) можно получить в процессе растворения чистой меди, ее оксида или гидроксида в азотной кислоте. Уравнения выглядят следующим образом:
Получение сульфида меди
Сульфид меди(II) или моносульфид меди — CuS, является неорганическим бинарным соединением двухвалентной меди с серой. Он верного цвета, в воде не растворяется , также как и в разбавленных растворах кисло. В природе его можно встретить в виде редкого минерала ковеллина.
Получение сульфида меди осуществляется при помощи прямого взаимодействия элементов, а также в результате обменной реакции солей двухвалентной меди с водорастворимыми сульфидами.
- Na2S+CuSO4=CuS+Na2SO4
- CuCl2 + H2S —> CuS + 2HCl
- 2CuS + H2 —>Cu2S + H2S. Эта реакция протекает в условиях высокой температуры от 600 до 700 oC
Получение сухим методом дает сульфиду меди возможность проводить электрический ток. Когда отметка термометра достигает 400 °C, наблюдается заметное разложение сульфида.
Производство меди
Применение меди в качестве материала для производства орудий труда и оружия известно человечеству многие столетия. Развитие электротехники и электроники явилось дальнейшим стимулом разработки совершенных методов добычи и переработки сырья, в котором присутствует этот металл. Современное производство меди – это хорошо отработанный процесс.Одной из проблем получения этого дефицитного металла является низкий процент содержания меди в добываемой руде. Он не превышает пять процентов от общего числа добываемой породы.
Способы производства меди
В настоящее время разработано несколько способов получения меди. Основными являются:
- пирометаллургия;
- гидрометаллургия;
- электролиз.
Наибольшее количество производится с применением первого способа. С его помощью получают практически 90% всего металла. Он достаточно трудоёмкий и продолжительный. Технология производства меди этим способом включает несколько этапов, которые осуществляют обогащение поступающего материала, последовательное получение готового материала. Каждый из этапов содержит строгую последовательность технологических задач. Обычно завод по производству меди выполняет весь комплекс операций.
Для получения так называемой катодной меди используется третий способ. Полностью этот способ называется – электролитическое рафинирование с последующим осаждением готового продукта на поверхности металлических пластин.
Стадии пирометаллургического производства меди
Данный способ эффективно применяется для переработки руды с различным содержанием меди. Он состоит из следующей последовательности действий:
- подготовки (обогащения)добытого сырья;
- непосредственной плавки на штейн;
- конвертирования полученного штейна;
- окончательного рафинирования.
Каждый технологический процесс осуществляется с применением необходимых методов обработки.Для выделения черновой меди производят так называемую продувку. Далее медь помещают в формы или разливают на плиты. Она остаётся загрязнённой различными примесями и не обладает свойствами чистой меди.
Сущность процесса заключается в подаче под давлением воздуха через жидкий расплав медного штейна. Она производится в специальных конвертерах, которые могут располагаться вертикально или горизонтально. В дальнейшем обогащённые концентраты медных руд поступают на конечную переработку.
Обогащение
Первоначально в добытой руде содержание меди не превышает шести процентов. Для производства меди с наилучшей эффективностью необходимо произвести обогащение добытой руды.Это производство предназначено для получения концентрата, в котором будет содержаться меди более 10%. В отдельных случаях его удаётся довести до 35%.
Основным способом обогащения сульфидных медно-никелевых руд является флотация. Для повышения эффективности обогащения предварительно проводят операцию магнитной сепарации. Она способствует выделению пирротина в самостоятельный концентрат. Возможность проведения магнитной сепарации обусловлена относительно высокой магнитной восприимчивостью пирротина.
Сам процесс включает следующие операции:
- предварительное дробление и последующий размол на мелкие частицы (он проводится до момента получения зерен не более 0,05÷0,5 мм);
- флотационное обогащение, которое основано на обработке несмачивающихся частиц руды совместно с пузырьками продуваемого воздуха при подъёме их вверх в виде пены (для эффективности процесса добавляется масло), пустая порода, смачиваясь опускается вниз.
После получения обогащённого материала приступают к следующему этапу.
Пирометаллургия определяет два типа обжигового процесса. Первый заключается в так называемом окислительном обжиге. В нём производят частичное окисление сульфидов медных концентратов. Данный процесс протекает в одном из трёх режимов: кинетическом, диффузионном и промежуточном. Каждый из них характеризуется величиной скорости протекания кристаллохимического превращения и значением коэффициента диффузии.
Правильный выбор этих параметров позволяет значительно понизить содержание серы, получить штейн требуемой концентрации. Такой обжиг производят в специальных агрегатах. Они называются обжиговые печи. С их помощью удаётся понизить содержание влаги до пяти процентов и одновременно уменьшить содержание серы. Современная схема этого процесса предполагает проводить его в кипящем слое или во взвешенном состоянии.
Второй способ предполагает проведение нагрева до температуры, активирующей окисление сульфида серы. Высшие фракции проходят стадию диссоциации. Низшие фракции подвергаются окислению незначительно.
Выбор оптимальной температуры для этого процесса зависит от следующих условий:
- параметров процесса сжигания топлива;
- характеристик теплообмена;
- качества изоляционных свойств печи (её стойкость футеровки);
- характеристик теплообмена самого перерабатываемого материала.
Наиболее популярным считается метод обжига медного концентрата в многоподовых печах. В них одновременно осуществляется механическое перемешивание загруженной смеси. Наибольшая эффективность технологического процесса проявляется в печах десятиподовой конструкции. В таких печах не только наиболее эффективно удаляется сера, но и качественно перемешивается концентрат введёнными добавками и флюсами. В этом случае такая печь исполняет роль смесительного аппарата. В печи поддерживается температура в интервале от 450 до 500 градусов. Состав загружаемой смеси и качество обжига (десульфуризации) зависит от оптимальности выбранных параметров.
Кроме этого метода существует обжиг готовых концентратов в кипящем слое. Для его реализации используются специальные агрегаты способные создавать такие условия. Их сложная и дорогостоящая конструкция существенно ограничивает их применение.
Плавка на штейн
Основными составляющими в сырье для получения штейна являются сульфиды двух металлов: железа и меди. В его составе присутствуют оксиды различных металлов, например, алюминия, кальция. Проведение процесса плавки позволяет получить два продукта в жидком виде. Одним является штейн, в котором концентрируется медь. Она переходит туда из оксидов шихты. Вторым получается шлак. В нём сохраняются остальные соединения.
Сырьём для выплавки служит подготовленный концентрат. Его смешивают с флюсом. Они должны стимулировать протекание этого процесса. Такими добавками служат известняк или кварц. Сплав штейн получают несколькими способами. Для этого используют отражательные, шахтные и электродуговые печи.
Наибольшую популярность получил технологический процесс плавки в отражательных печах.Они имеют следующие геометрические размеры: длиной до сорока метров, ширина не превышает десяти метров и максимальная высота от пода до свода должна быть не более четырёх с половиной метров. Под печи, опирается на оборудованный фундамент. Его изготавливают несколькими способами. Может применяться специальный динасовый кирпич, или наваривают из кварцевого песка. Наиболее оптимальной толщиной пода считается размер от 0,6 метра до 1,5 метров. Стены изнутри выкладывают магнезитохромитовым кирпичом. Свод изготавливают арочным распорно-трапециевидной формы. Для извлечения готового штейна готовят специальные шпуры. После завершения операции выгрузки они закрываются глиняной пробкой. В некоторых конструкциях для выгрузки устанавливают специальные сифонные устройства.
Рафинирование с использованием катодной меди
Процесс рафинирования предназначен для выделения чистой меди из различных добавок и примесей. В современной промышленности экономически целесообразным считается проведение этого процесса в два этапа. Первый заключается в температурном рафинировании, второй в электролитическом. Второй способ осуществляется с применением катодной меди.
Проведение электролитического рафинирования позволяет решить две задачи:
- Глубокую очистку от примесей.
- Обеспечение высокой электропроводности.
В зависимости от состава сырья в отдельных случаях удаётся получить сопутствующие металлы (серебро, селен и даже золото). Сам технологический процесс протекает в специальных ваннах длиной до 5 метров и глубиной до 1,5 метров. Стенки таких ванн обработаны кислотостойкими материалами. Над ванной создаётся система крепления, к которой закрепляют катоды. В качестве катодов используют плоские пластины, изготовленные из чистой меди. Одна пластина исполняет роль катода, вторая – анода. Ванна заполняется электролитом. В качестве электролита применяется серная кислота (H2SO4)в которой растворён сульфат меди(CuSO4). К этим катодам подаётся невысокое напряжение величиной 0,4 В. После замыкания цепи начинается процесс электролитического растворения анода. Под воздействием разности потенциалов ионы меди с анода переходят на катод, оседая на нём в виде чистой меди. Электролит периодически обновляют. Это необходимо, так как в его составе образуются растворы металлов, замедляющие процесс электролиза. Кроме этого на дне ванны накапливается осадок называемый шлам. Его также периодически выгружают. На современных предприятиях полное растворение анода происходит в течение 30 суток.
Последовательность выгрузки производится с интервалом от шести до двенадцати суток. Процесс электролиза достаточно электрозатратен. Для получения одной тонны чистой меди необходимо обеспечить мощность до 350 кВт.
Полученные катоды направляются для дальнейшей переработки. В итоге получают отдельные слитки или заготовки заданной формы. Плавка катодов производится в отражательных или печах шахтного типа. Создание температуры при которой плавятся катоды осуществляется сжиганием природного газа, с использованием электродуговых или индукционных установок. Полученная медь разливается по готовым формам. Для получения проволоки её помещают в так называемые вайербасы. Весь процесс происходит на установках непрерывной или полунепрерывной разливки.
Производство меди в России и мире
По данным аналитических агентств Российская Федерация уверенно занимает пятую позицию среди стран, занимающихся добычей и получением чистой меди. Производство меди в России в среднем за год составляет 860 тысяч тонн. Основу современной структуры производства меди составляют три крупных холдинга: ОАО «ГМК» Норильский никель» («Норникель»), ООО «УГМКХолдинг» (УГМК) и ЗАО «Русская медная компания» (РМК). Эти компании осуществляют полный цикл производства от добычи руды до изготовления готовых слитков, проката и проволоки. В каждый холдинг входит несколько предприятий, оснащённых самыми совершенными технологиями производства. Благодаря динамическому развитию в прошлом году удалось повысить производство меди на семь процентов.
Мировое производство меди достаточно консолидировано. Почти 35% этого металла производиться пятью крупнейшими компаниями. К ним относятся:
- Codelco (Чили).
- Freeport-McMoRan (США).
- Glencore (Швейцария).
- BHP Billiton (Австралия).
- Southern Copper (Мексика).
Эти компании почти 80% меди получают из первичного сырья (то есть осуществляют полный цикл переработки) и 20% производят в результате переработки поступающего лома. В Европе наиболее крупными производителями меди являются: Польша, Португалия и Болгария. Каждый завод способен осуществлять выпуск широкого ассортимента медной продукции. Несмотря на современный кризис, медь по-прежнему остаётся востребованным металлом. Одним из серьёзных недостатков, присущих этому производству являются экологические проблемы. Оценка выбросов на медеплавильных заводах показали высокий уровень загрязнения окружающего воздуха. В его составе присутствует большое количество вредных для здоровья химических соединений (кадмия, ртути, мышьяка, свинца, оксидов азота и углерода).
Производство меди
Для получения меди применяют медные руды, а также отходы меди и её сплавы. В рудах содержится 1 – 6% меди. Руду, содержащую меньше 0,5% меди, не перерабатывают, так как при современном уровне техники извлечение из неё меди нерентабельно.
В рудах медь находится в виде сернистых соединений (CuFeS2 – халько-пирит, Cu2S – халькозин, CuS – ковелин), оксидов (CuO, CuO) и гидрокарбонатов [CuCO3·Cu(OH)2,2CuCO3·Cu(OH)2]
Пустая порода руд состоит из пирита (FeS2), кварца (SiO2), различных соединений содержащих Al2O3, MgO, CaO, и оксидов железа.
В рудах иногда содержится значительные количества других металлов (цинк, золото, серебро и другие).
Известны два способа получения меди из руд:
Гидрометаллургический не нашел своего широкого применения из-за невозможности извлекать попутно с медью драгоценные металлы.
Пирометаллургический способ пригоден для переработки всех руд и включает следующие операции:
- подготовка руд к плавке;
- плавка на штейн;
- конвертирование штейна;
- рафинирование меди.
Подготовка руд к плавке
Подготовка руд заключается в проведении обогащения и обжига. Обогащение медных руд проводят методом флотации. В результате получают медный концентрат, содержащий до 35% меди и до 50% серы. Концентраты обжигают обычно в печах кипящего слоя с целью снижения содержания серы до оптимальных значений. При обжиге происходит окисление серы при температуре 750 – 800 °С, часть серы удаляется с газами. В результате получают продукт, называемый огарком.
Плавку на штейн
Плавку на штейн ведут в отражательных или электрических печах при температуре 1250 – 1300 °С. В плавку поступают обожженные концентраты медных руд, в ходе нагревания которых протекают реакции восстановления оксида меди и высших оксидов железа
6CuO + FeS = 3Cu2O + FeO + SO2
В результате взаимодействия Cu2O с FeS образуется Cu2S по реакции:
Сульфиды меди и железа, сплавляясь между собой, образуют штейн, а расплавленные силикаты железа, растворяя другие оксиды, образуют шлак. Штейн содержит 15 – 55% Cu; 15 – 50% Fe; 20 – 30% S. Шлак состоит в основном из SiO2, FeO, CaO, Al2O3.
Штейн и шлак выпускают по мере их накопления через специальные отверстия.
Конвертирование штейна
Конвертирование штейна осуществляется в медеплавильных конвертерах (рисунок 44) путем продувки его воздухом для окисления сернистого железа, перевода железа в шлак и выделения черновой меди.
Конвертеры имеют длину 6 – 10 м и наружный диаметр 3 – 4 м. Заливку расплавленного штейна, слив продуктов плавки и удаление газов осуществляют через горловину, расположенную в средней части корпуса конвертера. Для продувки штейна подается сжатый воздух через фурмы, расположенные по образующей конвертера. В одной из торцевых стенок конвертера расположено отверстие, через которое проводится пневматическая загрузка кварцевого флюса, необходимого для удаления железа в шлак.
Процесс продувки ведут в два периода. В первый период в конвертер заливают штейн и подают кварцевый флюс. В этом периоде протекают реакции окисления сульфидов
2FeS + 3O2 = 2Fe + 2SO2,
Образующаяся закись железа взаимодействует с кварцевым флюсом и удаляется в шлак
По мере накопления шлака его частично сливают и заливают в конвертер новую порцию исходного штейна, поддерживая определенный уровень штейна в конвертере. Во втором периоде закись меди взаимодействует с сульфидом меди, образуя металлическую медь
Таким образом, в результате продувки получают черновую медь, содержащую 98,4 – 99,4% Cu. Полученную черновую медь разливают в плоские изложницы на ленточной разливочной машине.
Рафинирование меди.
Для получения меди необходимой чистоты черновую медь подвергают огневому и электролитическому рафинированию. При этом, помимо удаления примесей можно извлекать также благородные металлы.
При огневом рафинировании черновую медь загружают в пламенную печь и расплавляют в окислительной атмосфере. В этих условиях из меди удаляются в шлак те примеси, которые обладают большим сродством к кислороду, чем медь.
Для ускорения процесса рафинирования в ванну с расплавленной медью подают сжатый воздух. Большинство примесей в виде оксидов переходят в шлак (Fe2O3, Al2O3, SiO2), а некоторые примеси при рафинировании удаляются с газами. Благородные металлы при огневом рафинировании полностью остаются в меди. Кроме благородных металлов в меди в небольших количествах присутствуют примеси сурьмы, селена, теллура, мышьяка. После огневого рафинирования получают медь чистотой 99 – 99,5%.
Для удаления этих примесей, а также для извлечения золота и серебра медь подвергают электролитическому рафинированию.
Электролиз ведут в специальных ваннах, футерованных внутри свинцом или другим защитным материалом. Аноды изготовляют из меди огневого рафинирования, а катоды – из тонких листов чистой меди. Электролитом служит раствор сернокислой меди. При пропускании постоянного тока анод растворяется и медь переходит в раствор. На катодах разряжаются ионы меди, осаждаясь на них прочным слоем чистой меди.
Находящиеся в меди примеси благородных металлов выпадают на дно ванны в виде остатка (шлама). После электролитического рафинирования получают медь чистотой 99,95 – 99,99%.
Лекция 7. Гидрометаллургия меди.
Гидрометаллургические способы получения меди в принципе пригодны для переработки любых видов рудного сырья. Однако их обычно используют для извлечения меди из окисленных руд или предварительно обожженных сульфидных руд. Доля гидрометаллургических процессов в общем производстве меди за рубежом постоянно возрастает и составляет сейчас – 12-15 %. В СНГ эти способы пока почти не применяют; лишь небольшое количество меди извлекается выщелачиванием вскрышных пород в отвалах (кучах) и забалансовых руд.
Ограниченное применение гидрометаллургических способов в медной промышленности является следствием в основном малых запасов окисленных руд и сложности попутного извлечения золота и серебра. По этой причине гидрометаллургию используют главным образом для переработки бедных руд с нерентабельным содержанием благородных металлов, пустая порода которых не вступает в химическое взаимодействие с растворителем. Для практической выгодности гидрометаллургии необходимо также, чтобы медь находилась в форме легкорастворимого соединения или переводилась в растворимую форму без значительных затрат.
Любой гидрометаллургический способ, не считая подготовительных и вспомогательных операций, состоит из двух основных стадий: обработки рудного сырья растворителем (выщелачивание) и осаждения металла из раствора.
При выборе растворителя учитывается ряд требований. Основными из них являются дешевизна и доступность растворителя, эффективность его воздействия на компоненты руды, незначительное воздействие на минералы пустой породы и возможность его регенерации. Применительно к медному сырью этим требованиям в наибольшей степени удовлетворяют вода и растворы серной кислоты и сульфата трехвалентного железа.
Вода — наиболее дешевый и доступный растворитель — пригодна, как правило, для обработки сырья и полупродуктов, содержащих медь в форме сульфатов или хлоридов. В условиях естественного (природного) выщелачивания сульфидных минералов при совместном действии воды и кислорода воздуха происходит окисление сульфидов с образованием серной кислоты и сульфата трехвалентного железа, которые и растворяют в конечном итоге сульфиды.
Раствор серной кислоты — наиболее распространенный растворитель в гидрометаллургии меди. Он обладает достаточно высокой растворяющей способностью, дешев и легко регенерируется. Однако его невыгодно применять для сырья с повышенным содержанием основных породообразующих минералов (известняка, кальцита, доломита и т.д.) из-за резкого увеличения расхода растворителя на их растворение и невозможности регенерации H2S04 из сульфатов кальция и магния.
Сульфат трехвалентного железа является хорошим растворителем для многих природных сульфидов меди. Однако этот растворитель самостоятельного значения в гидрометаллургии меди не имеет. Причиной этому является гидролиз Fe2(S04)3 в водных растворах. Для придания устойчивости сульфату растворы нужно подкислять серной кислотой.
При совместном воздействии указанных двух реагентов на сульфидные минералы Fe2(S04)3 работает как окислитель сульфидов, а серная кислота является их фактическим растворителем. Сульфат трехвалентного железа при этом восстанавливается до FeS04. Регенерацию растворителя осуществляют путем окисления FeS04 до Fe2(S04)3 аэрацией (продувкой) воздухом, часто в присутствии определенного вида бактерий (бактериальное выщелачивание) и реже хлором.
Для выщелачивания медных руд и концентратов применяют несколько методов: выщелачивание в кучах; подземное выщелачивание; выщелачивание путем просачивания раствора через слой рудного материала (перколяция); выщелачивание в чанах с механическим перемешиванием (агитация); автоклавное выщелачивание (под давлением).
В отечественной металлургии меди нашли применение только первые два метода.
Кучное выщелачивание применяют для извлечения меди на месте из вскрышных пород (отвалов) старых и новых карьеров.
В качестве промышленного осадителя меди используют материалы на основе железа — железный лом, стружку, обрезь жести, обезлуженную консервную жесть, губчатое (пористое) железо и т.д. в связи с их достаточной активностью, доступностью и невысокой стоимостью.
В современной практике цементации меди наибольшее распространение получили цементационные желоба, вращающиеся барабаны и чаны с механическим перемешиванием.
Основной продукт цементации — цементную медь — отправляют для дальнейшей переработки на медеплавильные заводы. Она содержит 65-75 % Си, а остальное — в основном железо. Отработанные растворы с содержанием — 0,05 г/л Си направляют на выщелачивание. Извлечение меди при цементации составляет 90-98 %. Расход железа на цементацию I т меди колеблется от 1,5 до 2,5 т.
Основными недостатками цементационного осаждения меди являются: необходимость расходования серной кислоты при регенерации оборотных растворов, содержащих FeS04; необходимость дополнительной очистки (переработки) получающейся цементной меди для получения товарного продукта.
Экстракцию меди из бедных растворов органическими растворителями успешно используют на нескольких заводах в США и Африке. При экстракционном способе предусматривается в стадии реэкстракции органической фазы получение медного раствора, содержащего до 90 г/л Си. Такой раствор может быть переработан методом электролиза с получением чистой катодной меди или автоклавным способом на медный порошок.
Разработаны также сорбционные процессы для извлечения меди из окисленных медных руд и растворов после кучного или подземного выщелачивания с использованием ионообменных материалов, которые также позволяют получать медь в виде катодов или порошков.
Контрольные вопросы
1. Методы гидрометаллургии меди
2. Требования, предъявляемые при кучном выщелачивании меди
3. Организация работы кучного выщелачивания
Никель и его применение. Сырье для получения никеля. Современное состояние производства никеля
Никель и его применение
Никель — единственный «молодой» металлиз тяжелых цветных металлов, получивший широкое применение только в конце XIX в. Впервые как химический элемент никель был открыт в 1751 г.и выделен в чистом виде в 1804 г. Однако он был обнаружен в составе монетных сплавов, применявшихся еще в Ш столетии до н.э. До 1875 г.никель считался ювелирным металлом, стоилдорого и производили его в очень небольших количествах. Мировое производство никеля в 1875 г. составляло всего
500т, а затем качало быстро расти.
Чистый никель – металл светло-серебристого цвета. Никель обладает достаточно высокой прочностью и пластичностью. Он легко поддается механической обработке как в горячем, так и в холодном состоянии, легко прокатывается в листы толщиной до 0,02 мм и протягивается в проволоку диаметром до 0,01 мм.
В химическом отношении никель малоактивный металл, обладает высокую коррозионную стойкость в атмосфере воздуха, устойчив к воздействию воды и многих агрессивных сред.
С кислородом никель образует два основных оксида: NiO, Ni2O3. С серой никель образует сульфиды: NiS, Ni3S2.
С металлами никель образует многочисленные сплавы. Известны более 3000 никельсодержащих сплавов. В сплавах никель придает разнообразные ценные свойства (жаропрочность, кислотоупорность, вязкость, нержавеющие свойства…). В чистом виде никель используется для никелирования, для изготовления посуды с высокой коррозионной стойкостью, в качестве катализаторов. Среди цветных металлов по производству и потреблению никель занимает пятое место после алюминия, меди, свинца и цинка.
Сырье для получения никеля
Промышленное производство никеля возникло в конце XIX века почти одновременно на базе окисленных никелевых руд Новой Каледонии и сульфидных медно-никелевых руд Канады.
Окисленные (силикатные) никелевые руды являются рудами вторичного происхождения. Они образовались в результате выветривания главным образом змеевиков и состоят из простых и сложных гидратированных силикатов магния и железа, и алюмосиликатов, содержащих никель.
Основными никельсодержащими минералами в окисленных никелевых рудах являются гарниерит (Ni, Mg)O ∙ SiO2 ∙ 2H2O, ревдинскит и непуит 3(Ni, Mg)O ∙ SiO2 ∙ 2H2O и нонтронит nNiO ∙ (Al, Fe)2O3 ∙ 4SiO2 ∙ 4H2O. Никелевые минералы в рудах находятся в тонкодисперсионном состоянии. По внешнему виду они похожи на глину, для них характерны пористое, рыхлое строение, малая механическая прочность кусков, высокая гигроскопичность. Из-за отсутствия рациональных методов обогащения окисленные никелевые руды поступают непосредственно на металлургическую переработку.
В СНГ промышленные месторождения окисленных никелевых руд находятся на Урале, Казахстане и на Украине, за рубежом – в Новой Каледонии, на Кубе, Филиппинах, в США, Бразилии, Индонезии и Греции.
В сульфидных рудах никель присутствует главным образом в виде пентландита [(Ni,Fe)S], представляющего изоморфную смесь сульфидов никеля и железа переменного соотношения, и частично в форме твердого раствора в пирротине (Fe7S8).
Основным спутником никеля в сульфидных рудах является медь, содержащаяся главным образом в халькопирите (CuFeS2). Из-за высокого содержания меди эти руды называют медно-никелевыми. Кроме никеля и меди, в медно-никелевых рудах обязательно присутствуют кобальт, металлы платиновой группы (платина, палладий, родий, рутений, осмий и иридий), золото, серебро, селен и теллур, а также сера и железо. Таким образом, сульфидные медно-никелевые руды являются полиметаллическим сырьем очень сложного химического состава. При их металлургической переработке в настоящее время извлекают 14 (включая серу) ценных компонентов.
Химический состав сульфидных медно-никелевых руд следующий, %: Ni 0,3-5,5; Си 0,2 — 1,9; Со 0,02- 0,2; Fe 30 -40; S 17- 28; Si02 10 — 30; MgO 1- 10; А123 5- 8. По структуре медно-никелевые руды могут быть сплошными, жильными и вкрапленными. Чаше встречаются два последних типа руд. В зависимости от глубины залегания руду добывают как открытым, так и подземным способом.
В отличие от окисленных никелевых руд сульфидные медно-никелевые руды характеризуются высокой механической прочностью, негигроскопичны и могут подвергаться обогащению. Следует отметить, что обогащению обычно подлежат только сравнительно бедные руды (не более 1,5-2,5 % Ni). Богатые руды после соответствующей подготовки направляют на плавку.
В СНГ промышленные месторождения сульфидных медно-никелевыых руд находятся на Таймырском и Кольском полуостровах, за рубежом – в Канаде и Австралии.
Основным способом обогащения сульфидных медно-никелевых руд является флотация. Иногда флотационному обогащению предшествует магнитная сепарация, направленная на выделение пирротина в самостоятельный концентрат. Возможность проведения магнитной сепарации обусловлена относительно высокой магнитной восприимчивостью пирротина.
Выделение пирротинового концентрата при обогащении руды улучшает качество первичного никелевого концентрата вследствие вывода из него значительной части железа и серы и упрощает его последующую металлургическую переработку. Однако при получении пирротинового концентрата, содержащего до 1,5 % Ni, возникает необходимость в обязательной его переработке с целью извлечения никеля, серы и платиноидов.
Флотационное обогащение медно-никелевых руд может быть коллективным и селективным. При коллективной флотации за счет отделения пустой породы получают медно-никелевый концентрат. Однако и селективная флотация не обеспечивает полного разделения меди и никеля (особенно по выделению никеля). Продуктами селекции в этом случае будут являться медный концентрат с относительно небольшим содержанием никеля и никелево-медный концентрат, отличающийся от руды более высоким отношением Ni:Си. На практике такой концентрат обычно называют просто никелевым.
Таким образом, в зависимости от принятой схемы обогащения сульфидных медно-никелевых руд можно получать коллективные медно-никелевые, медные, никелевые и пирротиновые концентраты, состав которых приведен ниже.
Состав продуктов обогащения медно-никелевых руд
Ni Си Fe S SiO2
Коллективный 3,6-6,5 3,0-6,0 38-40 28-30 12-14
Никелевый 6-11 4-6 37-40 25-29 14-20
Пирротиновый 0,1-1,55 0,05-0,17 55-60 36-37 1-3
Как следует из приведенных данных, соотношение никеля и меди в медно-никелевых и никелевых концентратах изменяется примерно oт 2:1 до 1:2. Такие концентраты можно перерабатывать по одной и той же технологии. Медные концентраты с соотношением меди и никеля, равным 20:1, перерабатывают на медеплавильных заводах.
Кроме окисленных никелевых и сульфидных медно-никелевых руд, сырьем для получения никеля могут служить мышьяковистые руды, добываемые в Бирме и в Канаде.
Гидрометаллургическая переработка медных руд
Страницы работы
Содержание работы
19 вопрос (Гидрометаллургическая переработка медных руд)
гидрометаллургическая переработка медных руд
Бедные окисленные и смешанные медные руды, трудно поддающиеся обогащению, перерабатывают гидрометаллургическими способами. Медь из таких руд выщелачивают растворами серной кислоты или солей аммония (рис.26).
Выщелачивание проводят подземным способом (в кучах), просачиванием или перемешиванием пульп
Серная кислота легко переводит в раствор окисленные минералы, например малахит, по реакции:
Рис. 26. Способы выщелачивания меди из руд: а – выщелачивание в кучах; б – выщелачивание просачиванием (перколяция); в – выщелачивание в пульпе
Сульфидные минералы не реагируют с серной кислотой, только ковеллин и халькозин медленно взаимодействуют с ней и частично переходят в раствор.
Попутно с медью серная кислота растворяет минералы железа, поэтому в растворах постепенно накапливается сульфат оксида железа Fe2(SO4)3, способный реагировать с сульфидами меди, например,
Халькопирит и борнит взаимодействуют с ионами трехвалентного железа медленно и неполно.
Из полученных растворов медь осаждают цементацией железным скрапом по реакции:
После отделения осадка растворы возвращают на выщелачивание. Fe (II), в них окисляется кислородом воздуха до Fe (III), которое вновь растворяет минералы меди. Осадок цементной меди переплавляют и рафинируют.
1. Подземное выщелачивание может происходить естественным путем в результате накопления воды в горных выработках. Серная кислота образуется здесь от гидролиза солей железа:
Рудничные воды откачивают и осаждают из них медь цементацией.
Возвращая отработанные растворы в толщу рудного тела через сделанные для этого скважины, шурфы и канавы, достигают более полного и интенсивного выщелачивания меди.
2. Выщелачивание в кучах, известное с древних времен, иногда практикуется и в наши дни. Для этого бедную руду складывают на несколько наклонной водонепроницаемой площадке в большие кучи, имеющие форму усеченных пирамид. Растворы подают на кучу сверху и отводят их по канавам к цементационным установкам. Выщелачивание длится несколько лет, но кучи велики: в каждой из них десятки тысяч тонн руды, поэтому производительность может быть достаточно высокой.
3. Выщелачивание просачиванием подобно кучному, только руду загружают в прямоугольные бетонные или круглые деревянные чаны на ложное дырчатое дно из досок. Мелкие частицы предварительно удаляют классификацией, поэтому растворы просачиваются быстрее и выщелачивание проходит интенсивнее, чем в кучах.
4. Выщелачивание перемешиванием пульпы применяется для мелких фракций руды, трудно проницаемых для растворов при просачивании. Этот способ сравнительно дорог из-за больших затрат энергии на измельчение и перемешивание, однако он обеспечивает наиболее высокое извлечение меди в растворы.
Независимо от способа выщелачивания медь чаще всего осаждают из растворов цементацией; однако в некоторых случаях при получении богатых растворов выгодно электролитическое ее осаждение. Плотные электролитные осадки содержат не менее 99 % Сu, в то время как в рыхлых цементных осадках обычно не более 50–80 % Сu. Осаждение меди электролизом проводят в ваннах с нерастворимым свинцовым анодом. При этом на катоде разряжаются ионы Сu 2+ , на аноде молекулы воды разлагаются с выделением кислорода, а в растворе регенерируется серная кислота, нужная для выщелачивания. Процесс электролиза меди можно представить следующей схемой:
2CuSO42Cu 2+ + 2SO.
2Cu 2+ + 4е – → 2Cu; E° = + 0,34 в.
2CuSO4 + 2Н2О → 2Cu + 2SO + 4H + .
Потенциал процесса разложения молекул воды, включая перенапряжение кислорода, отрицательнее, чем потенциал реакции:
2SO – 2е = S2O Е° = 2,01 в.
На аноде всегда в первую очередь разряжаются анионы с более отрицательными потенциалами.
Растворы, загрязненные сульфатом окиси железа, невыгодны для электролиза: ионы Fe 3+ восстанавливаются на катоде вместе с медью, вызывая непроизводительный расход электроэнергии. Потенциал реакции восстановления железа на катоде положительнее потенциала меди:
В этих случаях железо предварительно удаляют из раствора либо восстанавливают его сернистым газом или цементной медью.
5. Выщелачивание солями аммония применяют для переработки окисленных и самородных руд.
Окисленные минералы меди легко образуют растворимые комплексные соединения с аммиаком. Для этого руду выщелачивают, просачивая через ее слой раствор углекислого аммония, содержащий аммиак.
Окисленная медь растворяется по реакции:
CuO + 2NH + 2NH4OH → Сu (NH3) + 3H2О.
Комплекс двухвалентной меди способен растворять металлическую – самородную медь:
Сu (NH3) + Сu → 2Сu (NH3).
Действием кислорода воздуха в присутствии аммонийных солей комплекс одновалентной меди окисляется и вновь становится растворителем для меди:
2Cu(NH3)+ 2NH+O2+2NH4OH → 2Cu(NH3)+3H2O.
После накопления меди в растворе в результате просачивания его через руду и продувки воздухом аммиачные комплексы разлагают острым паром:
Выпадающий при этом осадок CuO плавят с углем, получая медь, а газообразные аммиак и углекислоту возвращают на выщелачивание.
Гидрометаллургические способы имеют ограниченное применение – ими получают не более 10–12% всей меди. Главный недостаток гидрометаллургии – невозможность попутного извлечения золота и серебра, присутствующих почти во всех медных рудах. Гидрометаллургические способы выгодны, когда пустая порода не реагирует с реагентами–растворителями.