Содержание
- Состав электролита блестящего золочения:
- Химические и механические способы золочения металла
- Какие металлы и сплавы поддаются золочению
- Методы и способы золочения металла
- Приготовление состава для золочения в домашних условиях
- Электролит для золочения своими руками
- Электролита золочения своими руками
- Химический способ
- Гальваника
- Электролиты золочения различного назначения
Электролит для золочения своими руками
Золотые покрытия можно наносить непосредственно на медь, медные сплавы, серебро и никель. Наилучшие результаты при золочении металлов обеспечивает нанесение золота на никель. Введение в состав золотых осадков кобальта, меди, серебра, сурьмы, индия и некоторых других металлов, дает возможность получать золотые сплавы различных цветов, и имеющих улучшенные эксплуатационные свойства. Такие сплавы характеризуются мелкокристаллической структурой, низкой пористостью, повышенным блеском и высокой износостойкостью. Золотосеребряные сплавы — “зеленое” золото или золотомедные — “розовое” золото наносят только на подслой золота, серебра или сплавов золота. Из электролита “розовое” золото можно осаждать золотомедные сплавы значительной толщины и обладающие наибольшей твердостью среди всех двойных сплавов на основе золота. К тому же цвет получаемых покрытий при массовой доле золота в сплаве, равной 85%, почти не отличим от цвета металлургического золота 585-й пробы.
Для нанесения золотых покрытий методом гальванического золочения в основном используются цианистые электролиты золочения, которые большинству показателям обеспечивают наилучшие результаты, по сравнению с не цианистыми электролитами. Основным компонентом в таких электролитах является анион золота, исключающий возможность контактного вытеснения золота медью и другими металлами, а осаждение золота на поверхности детали происходит в результате восстановления металла из цианауратного комплекса. Цианистые электролиты золочения можно разделить на три основные группы: щелочные, нейтральные и кислые.
Щелочные электролиты содержат золото, в пределах 8-12 г/л, свободный цианистый калий или натрий 20-80 г/л, и соль щелочного металла, для повышения электропроводности раствора, 70-100 г/л. Процесс золочения и осаждения золота в щелочных электролитах проводят при катодной плотности тока в диапазоне 0,1–1,1 А/дм 2 , температуре электролита 60-80 о С и постоянном перемешивании. Режимы осаждения в щелочных электролитах несколько ограничены по сравнению с кислыми и нейтральными электролитами золочения, и помимо этого, их основным недостатком является накопление в растворе карбонатов, которые нужно периодически удалять. Щелочные электролиты золочения применяют в основном для получения первичного подслоя золота перед осаждением более толстых золотых покрытий.
Нейтральные электролиты золочения работают при рН = 6,0 — 8,0 и имеют низкое содержание свободного цианида, в пределах 1-2 г/л. Данные электролиты обладают низкой рассеивающей способностью, но имеют более высокий выход по току, чем щелочные электролиты и позволяют получать более низко пористые золотые покрытия. Но использование нейтральных электролитов золочения очень ограничено, так как в процессе работы в них накапливаются соли неблагородных металлов, что отрицательно сказывается на качестве получаемых золотых покрытий. Нейтральные электролиты золочения используются в основном для покрытия сплавами золото-медь и для нанесения покрытий большой толщины 20 мкм и более. Основными недостатками нейтральных электролитов золочения является их нестабильность и необходимость частой регенерации.
Кислые электролиты золочения работают при рН = 3 – 6, не содержат свободных цианидов, отличаются безвредностью и стабильностью, и имеют самое большое распространение, позволяя проводить процесс золочения при комнатной температуре 20-25 о С и достаточно больших плотностях тока, до 1,5 А/дм 2 , что является их основным преимуществом. И, несмотря на то, что данные электролиты имеют более низкий выход по току, чем щелочные и нейтральные электролиты золочения, они позволяют получать более высоко блестящие золотые покрытия.
Комментарий. Перемешивание электролита и повышение концентрации золота в электролите позволяет значительно повысить выход по току, однако увеличение содержания золота в электролите способствует повышению потерь драгоценного металла, поэтому максимальная концентрация его в электролитах не превышает 15 г/л.
Помимо этого, кислые электролиты золочения не содержат свободных цианидов и работают, также как и нейтральные электролиты, с нерастворимыми анодами (в качестве анода используется титановая пластина или сетка с иридиевым или платиновым покрытием). К недостаткам кислых электролитов золочения можно отнести их относительно низкую рассеивающую способность и более высокие внутренние напряжения получаемых осадков. Благодаря хорошим физико-химическим свойствам широкую популярность получили лимоннокислые электролиты золочения.
Состав электролита блестящего золочения:
Дицианаурат калия (K Au(CN2)2) — 20-22 г/л
Комплексное соединение кобальта с ЭДТА -25-27 г/л
Плотность тока до 4,5 А/дм 2 ; рН = 6,5-7,5; температура 20-32 о С.
Состав электролита блестящего золочения (повышенной твердости):
Дицианаурат калия (KAu(CN2)2) 4 г
Сернокислый никель (NiSO4) — 1 г/л
Плотность тока до 1,5 А/дм 2 ; рН = 3,0-4,5; температура 40-50 о С
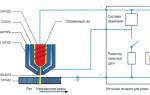
Оборудование для золочения использующееся в производственных цехах и лабораториях представляет собой регулируемый источник питания постоянного тока с высокой стабильностью, малым уровнем пульсаций, выдающий выходной ток до 20 А и обеспечивающий возможность малого “шага” регулировки до 0.05 А. Для золочения металлов и нанесения золотых покрытий используются нерастворимые аноды: титановая пластина или сетка с иридиевым или платиновым покрытием.
Для покрытия небольших по размеру деталей в гальванотехнике применяется золочение без тока: так называемый метод иммерсионного золочения. Покрытия, полученные методом иммерсионного золочения мало пористы, а время выдержки в электролите, в зависимости от толщины покрытия, составляет от нескольких секунд до нескольких минут. Ванны для иммерсионного золочения обычно изготавливают из стали или стекла.
Состав электролита иммерсионного золочения:
Золото (в пересчете на металл) — 1,2 г/л
Температура электролита 70 о С. Средняя скорость осаждения 1,5 мкм в час.
Выделение золота из отработанных электролитов золочения наиболее часто проводят контактным методом. Для этого, в отработанный электролит добавляют предварительно освинцованную мелкую цинковую стружку (освинцовывание проводят путем опускания стружки на 1 -2 минуты в раствор, содержащий 100 г/л уксуснокислого свинца). Для осаждения золота раствор выдерживают в течении 10-12 дней при комнатной температуре, добавляя в него каждые 2-3 дня, немного цинковой стружки (для проверки полноты осаждения золота, в отработанный электролит золочения на 5-7 мин добавляют порцию блестящей не освинцованной цинковой стружки; если стружка не темнеет, процесс восстановления закончен). Далее электролит фильтруют, оставшийся осадок с остатками стружки промывают, переносят в фарфоровую или стеклянную чашку и просушивают. После этого, осадок обрабатывают соляной кислотой (плотностью 1,19 г/см 3 ), тщательно промывают и затем обрабатывают, нагретой до 35-40 о С, азотной кислотой (плотностью 1,4 г/см 3 ), в результате чего, осадок приобретает цвет металлического золота. Для ускорения осаждения золота, электролит дополнительно разрушают путем добавления в отработанный раствор избытка серной кислоты. Восстановление золота в подкисленном растворе также проводят цинковой стружкой.
Химические и механические способы золочения металла
Гальваническое покрытие золотом металлических предметов: способы и технологии. Металлы и сплавы, поддающиеся золочению. Приготовление электролита для самостоятельного золочения в домашних условиях.
Золочение металла – популярная процедура, позволяющая придать различным изделиям свойства, которыми обладает благородный металл. Нанесение покрытия «под золото» позволяет получить отличную вещь при значительно меньших затратах, чем при покупке настоящего украшения. Кроме того, технология гальванического покрытия золотом исключает окисление металлов, поверхностный слой не боится влаги, не вступает в реакцию с химически активными веществами. Позолота также позволяет улучшить качество припоя, что важно при изготовлении микросхем.
Какие металлы и сплавы поддаются золочению
Золочение металлических поверхностей используется в различных областях, но наиболее часто:
- в промышленности для создания технических покрытий, устойчивых к химическому воздействию;
- в ювелирном деле, при декорировании поверхностей из черных и цветных металлов, нержавеющей стали.
Нанесение гальванического покрытия применяется для создания бижутерии. Для изготовления позолоченных изделий вещи из дешевых металлов покрываются тонким слоем золота. Такие «предметы роскоши» продаются по доступной цене, но смотрятся на уровне настоящих золотых. Технология гальванического золочения используется для браслетов, цепочек, колье, очков. Изделия выглядят изысканно и респектабельно.
Не менее распространена гальваническая обработка и более ценных металлов, например, золочение серебра или платины. Покрытая специальным составом бижутерия не приводит к появлению аллергии и раздражения кожи. Но такие изделия часто могут стоить на уровне высокопробных серебряных предметов.
Для придания требуемых свойств отдельным участкам поверхностей предметы либо украшения могут подвергаться гальваническому золочению частично. В ювелирном деле так создают уникальные вещи.
Гальваническому золочению можно подвергнуть любой предмет, повысив тем самым его свойства. К примеру, сусальное золото напыляется на купола храмов, применяется в иных декоративных целях.
Методы и способы золочения металла
- механический;
- химическое золочение с использованием активных веществ;
- гальваническое золочение.
Для каждого способа используются различные химреактивы и инструмент.
Химический метод
Химическое золочение – это нанесение на подлежащую обработке вещь хлорида золота. Для создания реагента необходимо последовательно выполнить такие действия:
- Металл расковывается на маленькие кусочки.
- Элементы помещаются в заранее сделанную смесь. Реагент изготавливается на основе соединения соляной (30 г) и азотной (10 г) кислот.
- На каждый грамм напыления должно расходоваться порядка 10 мл реагента. Потому необходимо заранее приготовить нужное количество раствора.
С кислотами в быту следует обращаться осторожно, не допуская их контакта с кожей рук и слизистыми оболочками.
Смешивание ингредиентов осуществляется в фарфоровой колбе, растворение при этом может растянуться на трое суток. По завершении подготовки благородного металла он выпаривается при 80 °C до образования жидкого раствора. Для получения гомогенного состава требуемой консистенции в процессе выпаривания раствор нужно периодически взбалтывать стеклянной мешалкой.
Непосредственно для процесса подготавливается:
- отфильтрованная вода, подогретая до 60 °C;
- золотая хлорная соль – 15 г;
- натрия хлорид либо карбонат калия – 65 г.
Предметы обрабатываются после заранее выполненной подготовки. Для удаления жира рекомендуется протирание 20%-м едким натром, затем – промывка в 25%-м содовом растворе.
Предмет помещается в сделанную смесь, и спустя определенное время (в соответствии с родом металла) поверхность превращается в позолоченную. После естественной просушки предмет протирается мягкой сухой тряпицей. Поверхность до появления блеска отполировывается шерстяным лоскутком.
Механические методы золочения
Обработка механическим способом выполняется нечасто, потому как добиться получения однородного поверхностного слоя нелегко. Данная технология отличается такими особенностями:
- Необходимо применение особой пасты, изготавливающейся в специальной лаборатории или самостоятельно. Для различных изделий ингредиенты пасты могут значительно отличаться.
- Нанесенное механическим методом в бытовых условиях покрытие в отличие от гальванического обладает малой толщиной. Потому такие изделия не смогут долго прослужить.
- Наиболее распространены растворы на основе винного камня, желтой соли кровяной.
- Для образования однородного состава кашеобразной формы, втираемого в поверхность изделия шерстяным лоскутом, вещество тщательно перемешивается.
- Перед нанесением позолоты требуется обезжирить поверхность.
- Нанесение пасты выполняется одним слоем с равномерным распределением золотой смеси. При втирании необходимо исключить контакт вещества с кожей рук.
Механическое золочение в отличие от гальванического – процесс сложный, применяемый в бытовых условиях лишь для отдельных частей предметов. Другие способы предусматривают полное погружение подлежащей обработке детали в специальный раствор.
Гальваническое золочение металлов
Необходимо учесть, что состав гальванического раствора влияет на приобретаемый поверхностью оттенок.
На дому электролитический раствор для создания гальванической позолоты изготавливается в такой последовательности:
- в отфильтрованную воду объемом 0,7 л вносится 60 г фосфорнокислого натра;
- для растворения 2,5 г хлорного золота добавляется 0,15 л воды;
- в 150 мл жидкости растворяются 1 г цианида калия и 10 г сернистокислого натрия.
При золочении гальваническим методом с ингредиентами, применяемыми для изготовления смеси, нужно обращаться осторожно, не допуская их пролива, попадания на кожный покров, глаза, слизистые.
Позолота вещей в этих растворах гальваническим методом занимает порядка 15 часов, на поверхности образуется матовая золотая пленка.
Приготовление состава для золочения в домашних условиях
При изготовлении раствора для золочения требуется применение таких ингредиентов:
- хлорного золота;
- соли поваренной;
- цианида калия;
- очищенной воды;
- соды.
Такой раствор предназначен преимущественного для обработки черных металлов. Для серебряных поверхностей требуется изготовление смеси для золочения в домашних условиях с иными ингредиентами:
- золота хлорного;
- калия карбоната;
- соли пищевой;
- желтой кровяной соли.
После воздействия смеси кислот предмет омывается водой и ненадолго помещается в ртуть. Далее вновь осуществляется опускание в воду, в ней вещь выдерживается в течение 30 секунд.
Затем вещь помещается в состав для гальванического золочения, выдерживается необходимое время и промывается водой. Сушка осуществляется на древесных опилках.
А вы пробовали выполнять золочение металлических предметов в домашних условиях? Какой метод вы использовали: гальванический, механический либо химический? Поделитесь, пожалуйста, полученным опытом в комментариях.
Электролит для золочения своими руками
Золочение в домашних условиях. Золочение металла. Золочение металлических предметов. Серебрение в домашних условиях. Серебрение металла. Серебрение. О золочении, серебрении, оксидировании. Для создания декоративных покрытий на всевозможных металлических и неметаллических поделках, например, на ювелирных изделиях, обычно применяется электролитическое осаждение на поверхность этих поделок каких-либо благородных металлов, электрохимическое оксидирование изделий из алюминия и его сплавов, а также другие способы.
Для электролиза понадобится источник постоянного тока низкого напряжения (3-5 В).
Качество создаваемых декоративных покрытий определяется многими обстоятельствами, например, типом и составом электролита, плотностью тока. Однако успех отделки зависит не только от правильно составленного электролита для гальванической ванны и поддержания точного режима гальванического процесса, но и предварительной подготовки изделий к гальваническому покрытию.
К такой подготовке относятся обезжиривание и травление обрабатываемых поверхностей для удаления оксидов, обычно покрывающих металл.
Обезжиривание. В зависимости от характера покрытия и свойств металла применяют следующие способы удаления жировых загрязнений: промывку поверхности органическими растворителями (керосин, бензин, уайт-спирит и др.); обработку щелочными растворами.
Обезжиривание органическими растворителями применяют в тех случаях, когда изделия загрязнены минеральными маслами.
Растворы для обезжиривания металлов
(смотри картинку)
Примечание. В скобках дано количество реактива (в граммах), растворенное в 1 л воды.
Обезжиривание щелочными растворами необходимо для удаления растительных масел: надежный результат дает обработка в горячем или кипящем растворе. С хорошо обезжиренной поверхности металла вода стекает равномерно, без образования капель.
Травление. Для снятия оксидов с бронзовых и медных изделий рекомендуется применять 5-10% раствор серной кислоты (температура — 40-60 °С). Продолжительность травления зависит от состояния поверхности.
Чтобы придать поверхности матовый вид, применяют следующий раствор, % (по массе):
азотная кислота (р=1,38 г/см ) . 8
серная кислота (р=1,84 г/см )……. 6
хлористый натрий…………43
сульфат цинка…………….43
Чем больше в ванне сульфата цинка, тем более матовой становится поверхность изделий. Продолжительность травления 2-10 мин.
При травлении изделий из алюминия, а также чтобы придать им белый цвет, изделия опускают в раствор едкого натрия или калия. Когда алюминиевые изделия очистятся, их помещают для осветления в разбавленную азотную кислоту, затем промывают водой, погружают в смесь из равных частей уксусной кислоты и воды, опять промывают в воде и сушат.
Золочение в домашних условиях. Золочение металла. Золочение.
Золото — единственный металл, обладающий устойчивым блестящим желтым цветом. Его отражательная способность 81%. Нанесение золотых покрытий с последующей обработкой поверхности матированием или полированием дает самые разнообразные декоративные эффекты. Золотое покрытие блестящее или матовое, ярко-красное или бледно-желтое, с элементами черной тонировки усиливает выразительность изделий.
Электролиты для желто-оранжевого золочения, состоящие из хлорного золота, железистосинеродистого калия (желтой кровяной соли) и соды, не содержат ядовитых цианистых солей. Однако такие электролиты (их называют железистосинеродистыми) хорошо «работают», если оптимальное соотношение компонентов в них строго выдержано.
Ниже приведены составы железистосинеродистых электролитов в граммах на 1 л дистиллированной воды. (Так же будут даны и все последующие составы.)
калий железистосинеродистый……200
хлорное золото……….50
сода кальцинированная………50
Температура ванны….50 °С.
Плотность тока……….0,01-0,05 А/дм.
калий железистосинеродистый……15
хлорное золото……..2,65
сода кальцинированная……15
Температура ванны……50°С.
Пло
Пользователь
Регистрация: 21.11.2005
Сообщений: 448
В друзьях у: 0
Голосов: 2 / 0
Пользователь
Регистрация: 21.11.2005
Сообщений: 448
В друзьях у: 0
Голосов: 2 / 0
Электролита золочения своими руками
Золочение в домашних условиях осуществляют двумя способами: электролитическим (гальваническим) и химическим. Для покрытия изделий позолотой требуются реактивы, которых не найти в свободной продаже: цианид калия, азотная и соляная кислоты. Также необходимо специальное оборудование: электролитические ванны и источник постоянного тока. Процесс золочения достаточно трудоемкий, требует сноровки, аккуратности и некоторого опыта.
Химический способ
А) Химическое золочение — процесс нанесения хлорида золота на металл, из которого сделано изделие. Хлорное золото готовится так: металл нужно расковать в фольгу и измельчить на мелкие кусочки, погрузить их в смесь азотной и соляной кислот (в так называемую царскую водку). Необходимо взять 30 г концентрированной соляной и 10 г концентрированной азотной кислот. На 1 г золота должно приходиться 10 мл раствора.
Нанесение позолоты в домашних условиях
Растворение должно происходить в фарфоровой посуде, процесс может длиться от нескольких часов до 2-3 суток. Когда металл полностью растворится, необходимо выпарить смесь в водяной бане при 70-80 градусах до появления вязкой золотистой жидкости. При выпаривании раствор помешивают стеклянной палочкой.
Чтобы приготовить смесь для золочения, потребуются:
- Горячая очищенная (дистиллированная) вода (50-60 градусов) в объеме 2 литра.
- 15 г сиропа хлорной соли золота.
- По 65 г карбоната калия (поташа) и хлорида натрия высокой очистки (соль «Экстра»).
Перед нанесением позолоты поверхность предмета необходимо обезжирить 10-20% едким натрием или кипячением в растворе соды. Далее промывают изделие в 25% растворе соляной кислоты, т. е. протравливают. После обезжиривания необходимо промыть предмет в воде.
Далее погружают изделие для позолочения в приготовленную смесь из горячей воды, поташа, хлорида натрия и хлорного золота. Предмета касаются цинковой палочкой, через некоторое время он становится позолоченным. После этого его извлекают и промывают, вытирают насухо и полируют при помощи шерстяной ткани.
Б) Помимо метода химического золочения используют метод натирания при помощи пасты. При таком способе нанесения позолоты слой покрытия тоньше. В состав пасты для натирания входит желтая кровяная соль (гексацианоферрат [II] калия), винный камень, порошок из мела, хлорное золото. Для изготовления 100 г пасты берут 55 г мела, 5 г кремортартара, 30 г желтого гексацианоферрата калия и 10 г хлорида золота, ингредиенты перемешивают. Полученную пасту разбавляют водой до образования кашицы. Этой смесью натирают обезжиренное изделие при помощи шерстяной ткани.
В) Существует третий метод покрытия. Для этого 10 г золота растворяют в смеси азотной и соляной кислоты, воды — всех компонентов взять по 25 г. Добавляют в этот состав 300 г поташа (карбоната калия). Готовят котел, в котором кипятится вода (2 л), вливают в нее эту смесь. Кипячение продолжается 2 часа.
Украшения, нуждающиеся в позолочении, прокаливают и протравливают сначала серной кислотой, потом азотной. Затем изделие обматывают проволокой из латуни (сплав цинка и меди), и погружают на мгновение в смесь азотной, серной и соляной кислот. Потом предметы ополаскивают, далее поочередно загружают их в ртуть, а потом в воду. Через полминуты их окунают в приготовленную жидкость, моют, высушивают в горячих опилках.
Изделие с позолотой
1) Железо и сталь.
Чтобы покрыть позолотой изделия из стали и железа, необходимо растворить сироп хлорида золота в эфире. Полученным составом, нанесенным на тряпочку, покрывают и натирают поверхность предмета из стали или железа. Затем эфир испаряется, а золото остается.
Если необходимо не просто покрыть позолотой изделие, а сделать на нем узор, то в смеси эфира с хлорным золотом смачивают перо и проводят им по предмету.
Желательно до позолочения предметов из железа, стали, олова, цинка покрывать поверхность медью, так как на нее лучше ложится позолота.
2) Цинковые предметы.
Покрытие цинковых изделий осуществляется при помощи натирания их пастой. Готовится она из 60 г цианида калия, 20 г хлорного золота и 100 г воды — эти ингредиенты смешиваются. В данный раствор добавляют 5 г кремортартрата и 100 г порошка карбоната кальция (мела). Полученный состав наносят при помощи щеточки или кисти.
Для покрытия серебряных украшений есть два варианта раствора, в которые погружают предметы:
- 10 г хлорида золота, 30 г калия цианида, соды и хлорида натрия по 20 г, полтора литра воды.
- 7 г хлорида золота, по 30 г поташа, желтого гексацианоферрата калия и хлорида натрия, литр воды.
Во время погружения изделия необходимо прикоснуться к нему цинковой палочкой и оно начнет покрываться золотом. После этого предмет извлекается из раствора, промывается и вытирается, полируется шерстяной тряпкой.
Хлорид золота (2 г) и цианид калия (32 г) растворяют в 0,5 л воды. В других полутора литрах воды тем временем растворяют едкий калий (6 г) и фосфорно-натриевую соль (10 г). Смешивают оба раствора и кипятят.
Гальваника
Существует два способа:
- Готовят три раствора: 60 г фосфата натрия с 700 г воды; 2,5 г хлорида золота и 150 г воды; 1 г цианида калия и 10 г сульфата натрия со 150 г воды. Первые два раствора смешивают, третий добавляют последним. Температура — 50-60 градусов. Анод — из платины. При истощении электролитного раствора добавляют хлорид золота.
- Ванна по Зельми: по 1 г гексацианоферрата калия (желтого) и карбоната натрия смешать с 30 г воды, нагреть в чашке из фарфора. Добавить в смесь осажденное нашатырным спиртом золото. Кипятить в течение 10-12 минут. При испарении воды ее добавляют, пропускают через раствор ток элемента Даниеля. Время воздействия — 15-16 часов.
Способы позолоты в домашних условиях трудоемки и не всегда доступны. Предпочтителен метод химического золочения или натирания.
04.08.2017 09:49 2017-08-04T06:49:33.000Z
Как самому дома приготовить электролит — раствор для нанесения золота? Какие компоненты состава золочения? ВНИМАНИЕ. Не пренебрегайте техникой безопасности! Используйте средства индивидуальной защиты!
Эта статья предназначена для тех, кто только начинает заниматься гальванопластикой или уже замучался, выбирая самый подходящий рецепт электролита для своих идей. Я расскажу о электролитах матового и зеркального меднения, и об их совместном использовании.
Но, во-первых, не могу не сказать несколько слов о нашем основном орудии производства — блоке питания. Если вы серьезно решили заняться гальваникой, не покупайте дешевый китайский блок питания. Сходите на радиорынок вашего города и присмотрите подержанный блок питания советских времен.
Выглядит он примерно так. Такой блок питания идеально держит настройку, не греется, не шумит, не пахнет и работает без присмотра сутки напролет.
Но вернемся к рецептам электролитов.
Итак, сернокислый электролит меднения состоит из двух основых компоненов — медного купороса и серной кислоты. Также в электролит вводятся различные блескообразующие и стабилизирующие добавки. Закон природы таков, что чем больше блескообразователей мы вводим в раствор, тем меньше серной кислоты он требует, и тем более хрупким получается изделие. Поэтому для каждой конкретной задачи выбираем свой электролит.
Общие правила смешивания электролита (на1 литр):
1. 500 мл дистиллированной воды разогреваем в микроволновке примерно до 80 градусов.
2. Высыпаем в горячую воду медный купорос, ждем, пока все растворится.
3. Через несколько слоев марли или х/б ткани процеживаем получившийся раствор.
4. Вливаем в раствор нужное количество серной кислоты.
5. Доливаем до 1 л. дистиллированной водой, вносим добавки, перемешиваем, оставляем на несколько часов.
1. Электролит матового меднения.
- 200 г медного купороса;
- 160 г серной кислоты;
- 1,5 кубика спирта (шприцом);
- совсем чуть-чуть желатина (2-4 гранулы).
Плюсы данного электролита:
1) хорошая пластичность изделия (при небольшой толщине можно гнуть просто пальцами, или греть на газу и придавать нужную форму).
2) слабая чувствительность к силе тока.
3) быстрое закрытие всей поверхности и быстрое наращивание толщины листа (экономит электричество).
1) матовая поверхность, плохо поддающяся шливовке до зеркального блеска.
Использование: на крупных (или живых) листьях, которые могут изменить форму в электролите. Для изделий сложной формы,которые нужно будет изгибать.
Впрочем, при наличии гравера со сменными насадками вполне возможно отшливовать даже такую матовую поверхность. На следующем фото эта поверхность в одном месте лишь слегка приполирована.
Но вся эта чистка и полировка требует времени и сил, так что, дабы не мучаться, получившийся матовый объект мы всего на пару часов опускаем в раствор №2.
2. Электролит зеркального меднения или электрохимической полировки
- 200 г медного купороса;
- 130-135 г серной кислоты;
- 1 капля унитиола (продается в аптеке);
- 0,05-0,08 г тиомочевины;
- 0,05 г соли.
1) совершенно зеркальное покрытие, не требующее дальнейшей обработки
1) Столь же совершенная хрупкость (данный электролит можно использовать только как электрохимическую полировку на уже говтовый омедненный объект).
2) Крайняя чувствительность к силе тока — об этом нужно говорить гораздо подробнее, но не в пределах данной статьи.
Использование: на не хрупких, не гнущихся объектах (например желуди) или как полировку на матово омедненный предмет.
В своей следующей статье я хочу дать рецепт универсального электролита, нечто среднее межу элеткролитом матового меднения и электролитом электрохимической полировки. Я называю его его электролитом гладкого меднения. Он прекрасно подходит для небольших листьев (не меняющих форму в растворе), веток и т.д., но. Об этом в следующей статье
А еще очень хочется рассказать про разные тонкости и хитрости: про создание равномерно крупитчатой структуры, или про наплывы меди, или про химическое и электрохимическое оксидирование (окраску в разные цвета), или про восстановление электролита.
Если у вас есть вопросы, можно задавать их в личном сообщении.
Электролиты золочения различного назначения
При золочении для декоративных целей внешний вид покрытия играет главную роль; цвет его может меняться от оранжевого 24К до цвета никеля. Подобные покрытия очень тонки — в пределах 0,5—1,75 мкм и, как правило, представляют собой сплавы. Легирующие компоненты в большинстве случаев добавляют в электролит в виде цианистых двойных комплексных солей (никель, кобальт, серебро, кадмий, медь, цинк). Олово вводят в электролит в виде станната. Чаще концентрация золота в электролите небольшая, в пределах 0,8—2,0 г/л. Температуру поддерживают в пределах 55—80° С; напряжение на клеммах ванны 4—10 В. Содержание свободного цианида от 0,3 до 40 г/л.
Барабанные ванны для получения покрытия такого же цвета, как и на подвесках, содержат мало золота (0,2—0,4 г/л), больше легирующего компонента (1 г/л Ni; 10 г/л Cu; 0,1 г/л Ag). Концентрацию свободного цианида поддерживают в пределах 15—30 г/л, чтобы обеспечить хорошую рассеивающую способность. Температура ниже, чем в стационарных ваннах (30—55°С).
Блестящие золотые покрытия. До 1950 г. в литературе не упоминалось о блестящих золотых покрытиях, за исключением очень тонких предварительных слоев. В 1952—1953 г. появились два электролита, в которых можно было получать золотые покрытия толщиной до 25 мкм. Они отличались концентрацией свободного цианида 45—200 г/л, золота в виде дицианоаурата 8 г/л и содержали некоторые добавки, такие как 1—2% Ag, Ni и другие, а также 30 г/л гипосульфита. Для получения блестящих покрытий требуются низкие температуры, порядка 10—25° С и соответственно плотность тока порядка 0,3—0,6 А/дм 2 . При нарушении условий процесса блестящие покрытия быстро темнеют и во избежание этого рекомендуется после обычной промывки изделий водой пропитывать их в течение 5 мин 5%-ной уксусной кислотой, затем вновь промыть водой и после этого 5 мин кипятить в воде.
Некоторые исследователи рекомендуют поддерживать постоянными значения рН на уровне 8—9 и вводить в электролит в качестве блескообразователей производные этилендиамина. Покрытия представляли собой сплав с содержанием 92% золота. Позднее те же исследователи видоизменили некоторые параметры, они довели содержание свободного цианида до высоких значений, а температуру поддерживали комнатную.
Для электролитов с высоким содержанием цианида был предложен ряд других блескообразователей: продукты конденсации жирных кислот с аминокислотами, оловом и никелем; некоторые вводили нитрогуанидин или нитромочевину; продукты конденсации сероуглерода и акриловые соединения как в электролиты золочения, так и серебрянозолотых сплавов.
Получение блестящих или полублестящих золотых покрытий при температуре 10—30° С решает целый ряд проблем и, в частности, расширяет область покрытия золотом печатных схем. Горячие щелочно-цианистые растворы разъедают места изоляции (пластмассу). Переход на малоцианистые электролиты или вовсе не содержащие свободного цианида, работающие при температуре ниже 30° С с выходом золота по току равным 90—98%, вносит большой вклад в совершенствование технологии золочения печатных схем.
Кислые электролиты. В США широко применяются солянокислые золотые электролиты как для нанесения толстых покрытий (больше 0,25 мм), так и для рафинирования — получения золота чистотой 99,9%. В толстых слоях покрытия получаются гладкими ярко-желтого цвета. Рекомендуемый электролит содержит 15—40 г/л золота и 75—125 мл/л соляной кислоты. Золотые аноды предпочтительны, так как на нерастворимых анодах, например угольных, выделяется хлор. Температуру поддерживают в пределах 40—80° С. Вследствие большой кислотности и агрессивности электролита хорошее сцепление покрытия с основой может быть обеспечено при условии предварительного нанесения промежуточного слоя из золота или из другого драгоценного металла на толщину 2,5—5,0 мкм. До солянокислого электролита был другой разбавленный кислый электролит, в котором золотили кончики перьев из нержавеющей стали. Этот электролит содержал 60 г/л NaCN, который добавляли к золоту, а непосредственно перед употреблением к раствору добавляли 125 мл/л НCl с таким расчетом, чтобы реакция стала кислой по лакмусу — значения рН в пределах 3—6.
По патенту Ринкера и Дува, кислый электролит золочения содержит 2—20 г/л дицианоаурата калия, от 10 до 150 г/л одну из устойчивых органических кислот, например лимонную, винную или уксусную, нейтрализованных до значений рН = 3-=-5, и 1—50 г/л одного или большего числа таких металлов, как никель, кобальт, индий или цинк. Другими авторами было предложено в кислые электролиты вводить блескообразователи или комплексообразующие вещества в виде этилендиамина, тетраэтиленпентамина, триэталонамина или различные продукты их замещения.
Толстые золотые покрытия порядка 125 мкм и больше могут быть получены из кислых хлористых электролитов и горячих цианистых электролитов с изменением направления тока, из нейтральных электролитов с солями органических кислот, из ферроцианидных электролитов. Во всех случаях содержание золота в электролите должно быть по крайней мере 15 г/л, а температура 50—70° С. Желательно перемешивание из расчета 100%-ного выхода металла по току.
Нейтральные электролиты. В целях уменьшения содержания свободного цианида в Европе стали применять при значениях рН = 6,5—7,5 различные процессы покрытия как чистым золотом, так и сплавом золото — медь под разными названиями. Несколько позднее стали применять блестящие кислые электролиты (с органическими соединениями).
Для интегральных схем рекомендуется следующий состав электролита (г/л) и режим:
Фосфат (C2H5)H2PO4 представляет собой смесь (в отношении 2:1) моно-(C2H5)H2PO4 и диэтилфосфорной кислоты плюс 1 % H3РO4. Эту смесь (плотностью 1,32) стабильную в кислых и щелочных растворах предварительно нейтрализуют гидроокисью калия. Эти электролиты золочения, по данным авторов, позволяют получать более яркие и гладкие покрытия при плотностях тока от 0,1 до 1,6 А/дм 2 и температуре 65° С с выходом по току 95%.
Было замечено, что в процессе эксплуатации электролита меняется его цвет, причем гамма цветов переходит от бесцветного через зеленовато-желтый к глубокому коричневому цвету. Изменение цвета электролита объясняется образованием органических примесей. Последние появляются в результате разрушения слоя фотосопротивлений, a также в процессе окисления на аноде цитрата:
2СnH2n + СO2 — 2е → 2CO2 + C2nН4n + 2 парафина.
Эта реакция обычно протекает в водных растворах карбокислот при высокой температуре предпочтительно на платиновых анодах и при плотности анодного тока около 20 А/дм 2 . При низких же плотностях анодного тока могут образовываться соединения типа СnH2n. Было установлено, что имеется некоторая потеря цитрат-иона и при электролизе с использованием золотых анодов при плотности тока 0,3 А/дм 2 .
Источником загрязнения могут быть также продукты окисления и полимеризации освободившихся CN-ионов:
2CN- — 2e → (CN)2↑,
CN- + Н+ → HCN + HCN + HCN. (HCN)х (полимер).
Образование полимеризованных продуктов катализируется в присутствии металлических примесей, таких как кобальт и никель.
Корректировку раствора золочения ведут в соответствии со значением водородного показателя, плотности тока, электропроводности, содержания золота. Раствор регулярно снабжают активированным углем. Водородный показатель поддерживают на постоянном уровне путем добавления сернистой кислоты (для понижения рН) или раствора едкого кали (для повышения рН). По данным автора, из некоторых растворов до замены их было высажено четырехкратное по отношению к начальному количество золота.