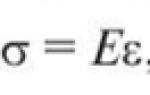Содержание
- Технология пассивации металла, виды и составы
- Суть и описание процесса пассивации металла
- Виды пассивирования
- Содержание составов для пассивации
- Пассивация металлов.
- 2.2.3. Характерные химические свойства алюминия.
- Взаимодействие алюминия с простыми веществами
- Взаимодействие алюминия со сложными веществами
- Пассивирование
- Пассивация металла
- Описание технологии
- Применение пассивации
- Виды пассивации
- Свойства металла после обработки
Пассивация алюминия азотной кислотой
Технология пассивации металла, виды и составы
Пассивация — это защита металла стойкими к коррозии тонкими поверхностными пленками. Свойства и применение пассивированных металлов и сплавов. Виды пассивирования и состав электролитов. Особенности и поэтапное описание технологии.
Пассивация — это формирование на поверхности металла тонких оксидных или солевых пленок, которые защищают его от внешней коррозии. Такое покрытие препятствует контакту металла с кислородом и агрессивными средами. При пассивировании защитные пленки могут образовываться на металлической поверхности как естественным, так и искусственным путем. В первом случае они состоят из оксидов химических элементов, входящих в состав самого металла, а во втором могут включать в себя оксиды и соли других химических элементов. Например, чистый алюминий естественным способом образует очень стойкую оксидную пленку, поэтому устойчив к большинству видов коррозии. А вот изделия из его сплавов, содержащих химически активные компоненты, уже нуждаются в искусственной коррозионной защите и поэтому подвергаются пассивированию в солевых растворах.
Пассивацию широко применяют для защиты поверхностей изделий из стали, меди, никеля, алюминия и их сплавов. Даже защитные цинковые и кадмиевые покрытия пассивируют солями хрома для повышения их коррозионной и механической стойкости. Пассивирование металла вызывает образование на его поверхности слоя оксидов или солей толщиной в несколько микрон, что практически не влияет на геометрические размеры изделий. С другой стороны, такие пленки могут снижать контактную проводимость основного материала, но, как правило, в меньшей степени, чем слой корродированного металла.
Суть и описание процесса пассивации металла
При пассивировании поверхности металлических изделий обрабатывают растворами химических соединений, обладающих окислительными свойствами. В этой роли чаще всего выступают кислоты, нитриты и растворы солей хрома (реже — молибдена). Нанесение раствора на поверхность металлических заготовок производится методом погружения или вручную, с помощью специального оборудования. Применяемые при пассивировании растворы обычно состоят из основного реагента и нескольких добавок, ускоряющих и стабилизирующих процесс пассивации.
В общем виде процесс пассивирования состоит из следующих этапов:
- Механическая очистка поверхностей изделия.
- Химическое обезжиривание в растворе едкого натра и кальцинированной соды.
- Промывка в проточной горячей, а затем холодной воде.
- Пассивирование в течение заданного времени.
- Нейтрализация в растворе кальцинированной соды.
- Промывка путем многократного погружения в проточную холодную воду.
- Сушка в сушильном шкафу или обдувом теплого воздуха.
- Контроль качества поверхности после пассивирования производится визуальным или инструментальным способом. При неудовлетворительном результате процесс пассивирования повторяется, начиная с п. 1.
Свойства пассивированного металла и его применение
Пассивация железа и его сплавов в виде конструкционных и специальных сталей обычно проводится по покрытию из никеля, цинка или кадмия с использованием солей хрома. Такое пассивирование укрепляет поверхностный слой и позволяет эксплуатировать стальные изделия в течение длительного периода без опасности коррозии, а в случае ее проявления обрабатывать только пораженные участки. Пассивирование меди и ее сплавов (бронзы и латуни) выполняется как в защитных, так и в декоративных целях с применением хроматных растворов. В этом случае на поверхности медного изделия образуется тонкая прозрачная пленка, предохраняющая металл от окисления и сохраняющая его товарный вид.
Пассивирование серебра проводят для этих же целей с применением аналогичных технологий.
Виды пассивирования
Химическое
Химическое пассивирование происходит в результате притяжения отрицательных ионов растворенных в воде солей к поверхности металла, атомы которого имеют положительный потенциал. Для этого металлические изделия, предварительно очищенные и обезжиренные, помещаются в специальную ванну, заполненную соответствующим раствором. Основным компонентом в таком электролите является соль металла, образующего защитную пленку на поверхности изделия. Химическая пассивация также может выполняться по месту установки изделия. В этом случае все процессы, начиная от очистки и заканчивая пассивацией, нейтрализацией и обмывкой, выполняются вручную с помощью специального оборудования.
Электрохимическое
Содержание составов для пассивации
Все соли хрома (особенно шестивалентного) очень токсичны. Поэтому проводить хромовую пассивацию металлических изделий можно только на специализированных производствах, имеющих соответствующие системы очистки и водоотведения, а также специально обученный персонал.
Нигде не пишут, каким образом выполняется пассивирование солями хрома непосредственно в местах установки оборудования. Как в этих случаях удаляют химические реагенты? Или при такой обработке применяют другие составы? Если кто-нибудь располагает информацией по данному вопросу, поделитесь, пожалуйста, в комментариях к нашей статье.
Пассивация металлов.
Процесс пассивации металлов означает создание на поверхности тонких пленок с целью защиты от коррозии. Эти пленки, образующиеся под воздействием растворов, создают плотный, почти непроницаемый барьер, благодаря чему коррозия сильно тормозится или полностью прекращается.
Существует несколько теорий механизма пассивации металлов:
- Пленочная теория причину пассивности поверхности металла процессу коррозии объясняет образованием тончайшего, часто невидимого слоя из соединений металла;
- По адсорбционной теории механизм защиты металлов объясняется насыщением валентности поверхностных атомов путем образования химических связей с адсорбирующимися атомами кислорода;
- По электрохимическому механизму предполагается ионизация адсорбированного кислородного атома, вызывающего сдвиг электродного потенциала металла в положительную сторону, что способствует пассивации поверхности.
Процесс пассивации металлов чаще проводят с целью кратковременной защиты стальных деталей от воздействия окружающей среды. Эффективность такого метода защиты от коррозии определяется условиями пассивирования, составом металла, а также состоянием его поверхности.
Травление детали перед пассивацией.
Наибольшее повышение стойкости против коррозии достигается при пассивировании легированных сталей.
Пассивация металлов может проводится химически или электрохимически. Для химической пассивации малоуглеродистых сталей рекомендуется 9 – 10% -ный раствор бихромата калия. При комнатной температуре обработку ведут в течение 1 часа, а при нагреве до 60ºС – в течение 20 минут.
Электрохимически пассивацию металлов проводят для холоднокатаной стали в электролите, содержащем 20 – 30 г/л бихромата калия, 20 – 25 г/л фосфата натрия и 5 г/л едкого натрия, при температуре 80 – 85ºС в течение 3 – 5 секунд. Анодная плотность тока 8 – 10 А/дм 2 .
Для защиты стальных изделий при межоперационном хранении используют растворы, содержащие 0,2 – 0,5% NaNO2 и 0,3 – 0,5% Na2CO3. При комнатной температуре время обработки 30 – 40 минут, при 60 – 70ºС достаточно 5 – 10 минут.
В нейтральной среде детали можно обрабатывать 25 – 30% — ным раствором NaNO2. После высыхания на поверхности металла остается слой кристаллов нитрита натрия, который хорошо предотвращает коррозию в атмосфере с высокой влажностью.
Для временной консервации деталей рекомендуется применять растворы нитрита натрия с добавкой глицерина, что повышает их вязкость и способствует образованию на поверхности металла тонкого пассивирующего слоя.
Пассивирование легированных сталей производят в концентрированных растворах азотной кислоты, которая является сильным окислителем, иногда добавляют двухромовокислый калий.
Для стали Х18Н9Т раствор содержит азотную кислоту 400 – 800 г/л, время обработки при комнатной температуре 30 – 60 минут; для стали 2Х13 в составе раствора: азотная кислота 270 – 300 г/л, бихромат калия 20 – 25 г/л, температура 40 – 45ºС, время 15 – 20 минут.
После пассивации металлов внешний вид поверхности не меняется.
Необходимо следить, чтобы во время пассивации металлов не происходило газовыделения, которое свидетельствует о начале процесса травления.
Перед операцией пассивации металлов необходимо детали подготовить: провести обезжиривание (см. «Обезжиривание поверхности») и травление («Травление поверхности. Часть1»). С поверхностей деталей, прошедших термическую обработку, должна быть удалена окалина (см.«Травление поверхности. Часть 2»).
После пассивации металлов проводят тщательную промывку в проточной воде и нейтрализацию слабым (20 – 30 г/л) раствором аммиака.
Процесс пассивирования металлов широко применяется для защиты внутренней поверхности трубопроводов и теплообменного оборудования путем внешнего воздействия электрического поля, в результате чего металл на внутренней поверхности трубопровода пассивируется и не поддается коррозии.
2.2.3. Характерные химические свойства алюминия.
Алюминий — амфотерный металл. Электронная конфигурация атома алюминия 1s 2 2s 2 2p 6 3s 2 3p 1 . Таким образом, на внешнем электронном слое у него находятся три валентных электрона: 2 — на 3s- и 1 — на 3p-подуровне. В связи с таким строением для него характерны реакции, в результате которых атом алюминия теряет три электрона с внешнего уровня и приобретает степень окисления +3. Алюминий является высокоактивным металлом и проявляет очень сильные восстановительные свойства.
Взаимодействие алюминия с простыми веществами
с кислородом
При контакте абсолютно чистого алюминия с воздухом атомы алюминия, находящиеся в поверхностном слое, мгновенно взаимодействуют с кислородом воздуха и образуют тончайшую, толщиной в несколько десятков атомарных слоев, прочную оксидную пленку состава Al2O3, которая защищает алюминий от дальнейшего окисления. Невозможно и окисление крупных образцов алюминия даже при очень высоких температурах. Тем не менее, мелкодисперсный порошок алюминия довольно легко сгорает в пламени горелки:
с галогенами
Алюминий очень энергично реагирует со всеми галогенами. Так, реакция между перемешанными порошками алюминия и йода протекает уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:
С бромом, представляющим собой тёмно-бурую жидкость, алюминий также реагирует без нагревания. Образец алюминия достаточно просто внести в жидкий бром: тут же начинается бурная реакция с выделением большого количества тепла и света:
Реакция между алюминием и хлором протекает при внесении нагретой алюминиевой фольги или мелкодисперсного порошка алюминия в заполненную хлором колбу. Алюминий эффектно сгорает в хлоре в соответствии с уравнением:
При нагревании до 150-200 о С или после поджигания смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с выделением света:
— сульфид алюминия
При взаимодействии алюминия с азотом при температуре около 800 o C образуется нитрид алюминия:
с углеродом
При температуре около 2000 o C алюминий взаимодействует с углеродом и образует карбид (метанид) алюминия, содержащий углерод в степени окисления -4, как в метане.
Взаимодействие алюминия со сложными веществами
Как уже было сказано выше, стойкая и прочная оксидная пленка из Al2O3 не дает алюминию окисляться на воздухе. Эта же защитная оксидная пленка делает алюминий инертным и по отношению к воде. При снятии защитной оксидной пленки с поверхности такими методами, как обработка водными растворами щелочи, хлорида аммония или солей ртути (амальгирование), алюминий начинает энергично реагировать с водой с образованием гидроксида алюминия и газообразного водорода:
с оксидами металлов
После поджигания смеси алюминия с оксидами менее активных металлов (правее алюминия в ряду активности) начинается крайне бурная сильно-экзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) развивается температура 2500-3000 о С. В результате этой реакции образуется высокочистое расплавленное железо:
Данный метод получения металлов из их оксидов путем восстановления алюминием называется алюмотермией или алюминотермией.
с кислотами-неокислителями
Взаимодействие алюминия с кислотами-неокислителями, т.е. практически всеми кислотами, кроме концентрированной серной и азотной кислот, приводит к образованию соли алюминия соответствующей кислоты и газообразного водорода:
2Аl 0 + 6Н + = 2Аl 3+ + 3H2 0 ;
с кислотами-окислителями
-концентрированной серной кислотой
Взаимодействие алюминия с концентрированной серной кислотой в обычных условиях, а также низких температурах не происходит вследствие эффекта, называемого пассивацией. При нагревании реакция возможна и приводит к образованию сульфата алюминия, воды и сероводорода, который образуется в результате восстановления серы, входящей в состав серной кислоты:
Такое глубокое восстановление серы со степени окисления +6 (в H2SO4) до степени окисления -2 (в H2S) происходит благодаря очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота в обычных условиях также пассивирует алюминий, что делает возможным ее хранение в алюминиевых емкостях. Так же, как и в случае с концентрированной серной, взаимодействие алюминия с концентрированной азотной кислотой становится возможным при сильном нагревании, при этом преимущественно протекает реакция:
— разбавленной азотной кислотой
Взаимодействие алюминия с разбавленной по сравнению с концентрированной азотной кислотой приводит к продуктам более глубокого восстановления азота. Вместо NO в зависимости от степени разбавления могут образовываться N2O и NH4NO3:
со щелочами
Алюминий реагирует как с водными растворами щелочей:
так и с чистыми щелочами при сплавлении:
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия:
В случае водного раствора алюминий, очищенный от защитной оксидной пленки, начинает реагировать с водой по уравнению:
Образующийся гидроксид алюминия, будучи амфотерным, реагирует с водным раствором гидроксида натрия с образованием растворимого тетрагидроксоалюмината натрия:
Пассивирование
ПАССИВИРОВАНИЕ электрохимическое, процесс, в результате которого металл делается неспособным к своим обычным реакциям и уподобляется благородным металлам. Например, железо, будучи обработано концентрированной азотной кислотой, теряет способность растворяться в кислотах, выделять медь из раствора медного купороса, растворяться на аноде при электролизе и т. д. Способностью пассивироваться кроме железа обладают в большей или меньшей степени никель, кобальт, хром, свинец, марганец, алюминий, олово, ванадий, ниобий, молибден, вольфрам, рутений, золото. Пассивирование металла часто наблюдается при электролизе; например, если анодно поляризовать железо в разведенной серной кислоте, то при небольших плотностях тока оно ведет себя нормально и переходит в раствор, давая сернокислое железо; если же путем повышения подводимого напряжения увеличивать плотность тока, то при достижении известной величины плотности тока, зависящей от природы раствора, в который погружено железо, сила тока начинает внезапно падать и в некоторых случаях может стать даже равной нулю. Если однако, приложенное напряжение достаточно для поддержания на анодной поверхности потенциала, необходимого для выделения кислорода, то прохождение тока, разумеется, не прекратится, но за его счет будет лишь выделяться кислород, а железо растворяться не будет.
Следует отметить, что ставшее пассивным железо не будет растворяться и в том случае, если плотность тока будет вновь снижена до значения меньшего того, при котором пассивность наступила. Если ток прекратить, то в кислой среде пассивность обычно через некоторый промежуток времени прекращается, в нейтральной удерживается в течение значительно большего времени, а в щелочной восстановления активного состояния обыкновенно не наступает. Присутствие в растворе хлоридов значительно ускоряет процесс восстановления активности, наоборот, присутствие окислителей (хромовые соли, перекись водорода и проч.) обычно ускоряет процесс пассивирования. Низкая температура благоприятно влияет на процесс пассивирования, в то время как при повышенной температуре пассивирование наступает при гораздо больших плотностях тока.
Процесс пассивирования вызывает соответствующие изменения потенциала металла, погруженного в раствор, причем это изменение всегда таково, что потенциал металла становится более электроположительным (благородным); часто это ведет к тому, что пассивированный металл начинает переходить в раствор в виде ионов своей высшей степени окисления. Типичный пример этому имеет место у хрома. Нормально он должен растворяться, давая Сг» аналогично Fe», однако если хромовый анод поляризовать в щелочном растворе, то только по достижении потенциала Eh = 0,62 V начинается растворение металла и притом в виде шестивалентных ионов Cr V I . Последние немедленно реагируют со щелочью:
Cr VI + 8ОН’ = СгO4» + 4 Н2О,
в результате чего получается хромовокислая соль. Аналогично этому железо в щелочном растворе дает ионы FeO4«, соответствующие солям железной кислоты (ферраты).
Наиболее общепризнанной теорией процесса пассивирования металлов является в настоящее время теория, предложенная в свое время еще Фарадеем, объясняющая процесс пассивирования возникновением на поверхности металла оксидной пленки. Основанием для такого воззрения являются следующие факты. 1) Пассивирование всегда связано с окислительным процессом либо с непосредственным воздействием окислителей, как кислород, озон, крепкая азотная кислота, соли хромовой кислоты, перекись водорода, либо с анодной поляризацией, что также связано с действием кислорода, выделяющегося на аноде, в то время как водород, восстановители, а также катодная поляризация металла способствуют обратному процессу — переходу металлов в активное состояние. 2) Разница в условиях, при которых пассивируются различные металлы, а именно: железо и никель лучше всего сохраняют свою пассивность в присутствии щелочей, в то время как кислоты способствуют удержанию активного состояния или облегчают переход в активное состояние, если мы имеем дело уже с пассивированным металлом. Правда, в очень крепких растворах щелочей анодно поляризованное железо может оставаться активным, что объясняется большой растворимостью окиси железа в концентрированной щелочи; то же самое имеет место у кобальта, который в разбавленной щелочи легко пассивируется, а в концентрированном растворе (8 N) легко растворяется под действием тока, давая растворимые кобальтиты . Металлы же, подобные вольфраму и молибдену, окислы которых имеют кислый характер, легко растворимы в щелочах и очень трудно в кислотах, ведут себя противоположно железу и никелю и пассивируются лучше всего в кислых растворах. 3) Возможность устранения пассивного состояния металла механическим путем (очистка металлической щеткой), после чего металл становится снова активным.
Возражения против этой теории обычно сводятся к следующему. 1) Металлы при пассивировании часто сохраняют свою поверхность блестящей, что заставляет сомневаться в наличии на их поверхности пленки окисла, тем более, что Мюллером и Кенигсбергером были произведены очень точные исследования оптических свойств пассивированных и непассивированных поверхностей металлов, не давшие никаких доказательств разницы в их оптических свойствах. 2) Для того чтобы объяснить пассивирование металлов азотной кислотой, надо допустить, что оксидная пленка в ней нерастворима, что представляется маловероятным, ибо обычно окислы металлов хорошо растворимы в кислотах. В одной из работ последнего времени теория оксидной пленки нашла себе подтверждение, устраняющее в основном все возражения против нее. Фрейндлих, Пачеке и Цохер показали, что если получить железо в вакууме без доступа кислорода (они получали железное зеркало на стекле термическим разложением паров пентакарбонила железа в вакууме), то оно не пассивируется концентрированной азотной кислотой, если же то же железо подвергнуть действию концентрированной азотной кислоты в присутствии воздуха, то пассивирование наступает. Следовательно, роль кислорода при процессе пассивирования можно считать окончательно установленной; авторам удалось также доказать, что на поверхности пассивированного железа получается тонкая пленка окисла, нерастворимого в азотной кислоте. Из других теорий пассивности можно указать на следующие. Леблан объясняет наступление пассивности уменьшением скорости образования ионов, что происходит вследствие поглощения поверхностью металла кислорода, но последний не образует с металлом окисной пленки, а дает твердый раствор; по Тамману такого рода поглощение кислорода объясняется насыщением свободных валентностей атомов металла, лежащих на поверхности, кислородом, но характер кристаллической решетки как для насыщенных кислородом атомов металла, так и ненасыщенных, лежащих под ними, остается по Тамману одинаковым. Эту форму поверхностного поглощения кислорода Эванс назвал «двухмерной окисью». По теории «значности» Крюгера и Финкельштейна у металлов, которые образуют ионы различной валентности, ионы существуют уже в металле и находятся между собой в известном равновесии; так, например, в случае железа имеет место равновесие между Fe’’- и Fе’’’-ионами. При нарушении равновесия вследствие перехода в раствор двухвалентных ионов восстановление его происходит не моментально, что ведет к тому, что на поверхности металла, граничащей с раствором, остаются только Fе’’’-ионы. Это вызывает соответствующее изменение потенциала металла и обусловливает более благородный характер пассивированного металла. Еще дальше такого рода взгляды развиты в теории Смитса, которым дана общая схема равновесия между атомами металла и ионами как в самом металле, так и в прилегающем к металлу слое раствора.
Пассивирование металла чрезвычайно благоприятствует сохранению металлов, т. к. оно парализует т. н. гальванокоррозию металлических предметов. Пассивированием объясняется также устойчивость таких металлов, как алюминий и магний, против действия кислорода и воды: слой окисла, образующегося на поверхности металла, предохраняет его от дальнейшего окисления; так как окись алюминия и магния нерастворима в воде, то эти металлы в силу этого не разлагают воды с выделением водорода, как это они должны были бы делать по своему положению в ряду напряжений. Образованием оксидной пленки на поверхности алюминия объясняется также способность алюминиевого электрода пропускать ток только в одном направлении, что находит себе применение в устройстве электролитических выпрямителей переменного тока. Существование оксидной пленки дает возможность пользоваться некоторыми металлами в качестве нерастворимых электродов при электролизе (железо, никель при электролизе щелочных растворов, свинец при сернокислотных). Использование железных сосудов для транспортирования концентрированной серной кислоты, железных баллонов для жидкого хлора и т.п. также основано на явлении пассивирования.
Пассивирование адсорбционное , явление понижения скорости реакции на твердых поверхностях кристаллов и металлов, например, понижение скорости их растворения в воде или кислотах, вызванное образованием на данной поверхности адсорбционного слоя полярных молекул поверхностно-активных веществ. Пассивирование адсорбционное — явление отрицательного гетерогенного (контактного) катализа. В технике уже давно известно, что скорость растворения металлов в водных кислотах сильно понижается (в 10—100 раз) от прибавления к водной среде фенола, углеводов, сульфокислот, нафтеновых и жирных кислот и др., чем и пользуются практики, например, для предохранения от потерь металла (при очистке поверхности листового железа от окислов) опусканием металла в кислую ванну (H2SО4 или НСl) — патент Фогеля, или, например, присадка антр , выработанная Степановым и Комовским в Химическом институте им. Карпова в Москве, и др.
Пассивирование адсорбционное вызывается веществами, поверхностно-активными по отношению к пассивируемой поверхности (адсорбируемыми ею). Механизм адсорбционного пассивирования тот же, что и при понижении скорости кристаллизации поверхностно-активными веществами, растворенными во внешней среде — явлении, исследованном ранее Фрейндлихом и Марком. Полярные молекулы поверхностно-активных веществ, адсорбируясь на поверхности металла, покрывают ее при достаточной концентрации как бы кристаллической мономолекулярной пленкой, препятствующей ионам металла переходить в раствор и замедляющей установление равновесия между металлом и раствором. С увеличением концентрации поверхностно-активного пассиватора скорость растворения металла понижается, стремясь к минимальному пределу, соответствующему образованию насыщенного адсорбционного слоя на металлической поверхности. Для количественного исследования пассивирования адсорбционного надо измерять кинетику растворения металла в чистой водной кислоте (например, в 10—20% H2SО4, НСl) сначала в отсутствии (фиг. 1, кривая а) пассиватора, а затем в его присутствии при разных концентрациях (кривые b, с, d, е) с сохранением постоянства объема раствора и при условии, что пассиватор не изменяет практического состояния минеральной кислоты в растворе.
Для измерения скорости растворения металла или кристалла, например, кальцита (СаСО3), в кислотах удобно измерять число пузырьков газа (Н2 или СО2), выделяющихся при постоянных условиях температуры и давления из остро обрезанного капиллярного кончика определенного диаметра в единицу времени (за 1 мин.). При этом N пропорционально скорости реакций где m масса вещества, перешедшего в раствор в г, а τ время в сек. Схема установки для измерения скоростей представлена на фиг. 2.
Растворение происходит в пробирке Р; капельная воронка А служит для добавления поверхностно-активного вещества, а кран Н для сообщения прибора с атмосферой. Пробирка Р при измерениях обыкновенно помещается в водяной термостат t. Для перемешивания раствора в пробирке служит электромагнитная мешалка Е из согнутой толстой платиновой проволоки, заканчивающаяся внизу площадкой из платиновой сетки; на эту площадку помещается кристалл кальцита или к мешалке тонкой платиновой проволочкой привязывают полоски из листового металла. В верхней части мешалки помещается платинированный железный полый цилиндрик с (толщина стенок в 0,5 мм). Мешалка приводится в действие сильным электромагнитом М, между полюсными наконечниками которого помещается пробирка. Постоянный ток, питающий электромагнит, прерывается посредством маятникового прерывателя-реле В, позволяющего изменять число перемешиваний (колебаний мешалки) от 30 до 120 и более в мин. Кроме того перемешивание можно ослабить или усилить перемещением электромагнита М вдоль пробирки или изменением силы тока с помощью реостата R. Пузырьки газа при растворении вещества в пробирке Р выходят из кончика капилляра К, погруженного в ванну-термостат Т. Пузырьки газа должны выделяться в жидкости, насыщенной данным газом и практически его больше не растворяющей (например, в крепком водном растворе NaCl).
Прекрасными пассиваторами являются чистые фенолы, ароматические углеводороды (бензол, толуол) в тех ничтожных концентрациях, в которых они растворимы в водной среде, спирты, жирные кислоты, сульфокислоты, камфара и разнообразные смеси этих веществ (Ребиндер), могущие служить для изготовления новых рецептур присадок. На фиг. 1 видно, что вначале скорость растворения металла как в присутствии пассиватора (кривые b, с и d), так и без него (кривая а), обычно растет со временем, очевидно благодаря увеличению поверхности при разъедании (поверхностному диспергированию — разрыхлению). При этом пассиватор, уменьшая скорость растворения, уплощает всю кривую кинетики (кривая е). В дальнейшем же (при малом количестве кислоты) она быстрее расходуется в отсутствии пассиватора, что в таком случае влечет за собой пересечение кривых кинетики (фиг. 3).
И. И. Жуковым и его сотрудниками было показано, что поверхностно-активные пассиваторы затрудняют установление нормального потенциала на границе «металл—раствор», чем и объясняется известное явление отравления, например, водородного электрода, поверхностно-активными веществами.
Источник: Мартенс. Техническая энциклопедия. Том 15 — 1931 г.
Пассивация металла
Одним из эффективных методов защиты поверхности металла от воздействия коррозии является обработка поверхности с помощью специальных химических растворов. При их взаимодействии с металлом протекает химическая реакция, в результате которой на поверхности образуется нейтральное (пассивное) соединение способное противостоять протеканию коррозийных процессов. Такая обработка называется пассивация металла. После завершения этого процесса на поверхности образуется оксидная плёнка. Она обладает химическими свойствами не вступать в реакцию окисления и тем самым предотвращает разрушение не только поверхностного слоя, но и всей детали.
Описание технологии
В основу пассивации положены принципы химического взаимодействия поверхностного слоя металла с различными растворами других металлов, в результате, которого, на поверхности образуется поверхностный слой с новыми физическими и химическими свойствами. Процесс пассивации предполагает создание абсорбционных (фазовых) слоёв, которые изменяют структуру первоначального металла. Слой пассивации создаёт надёжный барьер, который препятствует процессу окисления и служит надёжной защитой от коррозии.
Для проведения подобных химических реакций используется различный металл. Это зависит от состава исходного металла, из которого изготовлена деталь. Для придания ей специфических свойств могут применяться: хром, никель, кобальт, марганец, молибден и другие редкоземельные металлы. В зависимости от их процентного содержания готовят раствор для пассивации и выбирают необходимое оборудование.
При пассивации нержавеющей стали в процессе её производства в её состав добавляют различные легирующие металлы. Они обеспечивают лучшее взаимодействие с химическими элементами, входящих в состав пассивирующего раствора.
Например, для создания на поверхности стали надёжной антикоррозийной плёнки применяют оксид хрома. Производится операция хромирования.Она полностью меняет физико-химические свойства поверхностного слоя. При правильном проведении обработки получают ровный и одинаковый по плотности слой. Для проведения пассивации применяют различные кислоты. Чаще всего создаётся раствор на основе азотной кислоты. Именно созданные соли на основе этой кислоты создают на поверхности стали защитную плёнку с высокими защитными характеристиками.
После завершения технологического процесса проводят проверку качества полученного слоя. Это необходимо для оценки поверхности обработанной детали. На практике используют различные методы проверки. Например, используют химический метод: обрабатывают поверхность раствором ферроцианида калия в азотной кислоте. Такое воздействие позволяет визуально определить места некачественной обработки. В местах, где слой достаточно тонкий или отсутствует, то есть присутствует большое количество свободного железа, появиться характерный синий цвет. Этот способ применяется в заводских лабораториях. Им проверяют выборочные детали из готовой партии.
Более простым, но длительным считается способ помещения готового изделия в обычную воду. После длительного пребывания в воде, места с плохой обработкой покрываются ржавчиной.
Технология проведения пассивации цветных металлов практически не отличается от технологии обработки стали. Основным отличием является состав применяемых растворов. Например, для обработки алюминия, меди, никеля применяют хроматы калия и натрия или хромовый ангидрид. Ускорения процесса обработки осуществляется при добавлении в состав раствора различных солей и кислот. Пассивация меди производится в растворах серной кислоты, обработка поверхности меди производится в растворе фосфорной кислоты, цинка и кадмия в растворах соляной и азотной кислоты.
В некоторых случаях процесс взаимодействия раствора с металлом применяют для решения других важных технических задач.Процесс разложения металла под воздействием окислов применяется для изготовления печатных плат в радиотехнике. Эта процедура называется травление. В этом случае на поверхность металлизированной текстолитовой пластины наносится с помощью краски рисунок будущих токопроводящих полос и мест размещения радиодеталей. Затем пластину с нанесённым рисунком опускают в ванну с раствором, под воздействием которого происходит химическое удаление слоя металла с поверхности текстолита. В результате пассивации на поверхности остаётся только метал, защищённый краской. После этого пластину промывают в проточной воде и с помощью растворителей удаляют слой нанесённой краски. Результатом такой пассивации (травления) становиться готовая печатная плата для конкретного радиоэлектронного устройства.
Технология нанесения на основной слой изделия декоративного слоя не отличается от общего процесса пассивации. При создании ювелирных украшений на поверхность серебряной заготовки наносят тонкий слой золотой плёнки. Она формируется аналогичным образом. Таким образом, получают изделие с характерным золотым цветом.
Важным моментом для получения качественной плёнки при пассивации является финишная обработка. Во всех случаях необходимо после извлечении детали из ванны с раствором качественно её промыть. Это необходимо для того, чтобы прекратить процесс пассивации. Если оставить часть активного раствора или даже его разбавленные компоненты, будет нарушена технология и качество полученной плёнки значительно снижается. После тщательной промывки рекомендуется просушить готовую деталь. Это можно осуществить при естественной сушке или с применением специальных фенов. На производстве применяют сушильные камеры, которые обеспечивают равномерный поток тёплого воздуха. Качественная подготовка поверхности, соблюдение всех режимов обработки, соблюдение времени пассивации, качественная промывка исушка позволяют получить качественный равномерный защитный слой, способный прослужить достаточно длительный срок.
Применение пассивации
К основным задачам пассивации относятся:
- предотвращение коррозийных процессов, протекающих в верхних слоях металла;
- защита от разрушения вновь созданных соединений, например, в месте сварочного шва (пассивациясварных швов);
- повышение электропроводности в месте электрического контакта;
- создание печатных плат по подготовленным шаблонам (травление);
- обработка готового изделия с целью придания новых декоративных и потребительских свойств.
Первая задача решается для большого количества металлов и их сплавов.Одним вариантов такой защиты является воронение. Во втором случае для создания прочного сварного соединения применяется пассивация анодов и конечная обработка полученного соединения после сварки. Проведение пассивации позволяет значительно повысить герметичность, полученных соединений. Это особенно важно припрокладке трубопроводов. Такая обработка очень полезна при проведении сварки трудно свариваемых металлов, например алюминия. Пассивация меди или латуни производится для создания временной защиты от потускнения поверхности изделия на определённый срок (обычно около месяца). Иногда это используется как временная консервация подготовленных деталей для хранения между операциями дальнейшей обработки или сборки.
Данный вид обработки необходим при эксплуатации изделий из металлов в следующих случаях:
- применение крепёжных элементов, особенно в условиях агрессивных сред и больших механических нагрузок;
- при сборке трубопроводов, особенно в местах сварных швов;
- для защиты котельного оборудования;
- деталей машин и механизмов, контактирующих с морской водой;
- элементы конструкций, работающих при изменении температурных режимов;
- отдельные элементы ручного и механического инструмента;
- готовые изделия, применяемые в быту (дверные ручки, мебельная фурнитураи тому подобное);
- декоративные поделки для интерьера;
- в радиоэлектронике для улучшения качества контактов;
- ювелирные украшения.
Решение задач повышения электропроводности решается с помощью нанесения наповерхность изготовленных контактов тонкого слоя металл, обладающего повышенной электропроводностью, например золота или серебра.
Виды пассивации
Основными и наиболее хорошо отработанными видами пассивации являются:
Химическая
Химическая пассивацияпредполагает применение растворов солей различных металлов.Наиболее эффективно пассивация производится азотной кислотой. Кроме неё для формирования раствора пользуются серной кислотой или лимонной. Для повышения качества процесса в раствор добавляют небольшое количество бихромата натрия. Его количество не превышает 6% от общей массы. Состав раствора подбирается индивидуально и во многом зависит от марки обрабатываемого металла. Например, для пассивации железа применяют соли металлов, растворённые в серной кислоте высокой концентрации.
Сущность химической пассивации заключается в активном притяжении отрицательных ионов, которые присутствуют в растворе, к атомам металла.Это происходит благодаря наличию у них положительного заряда. В результате такой диффузии образуется поверхностный слой.
Для пассивации обязательно проводят предварительную подготовку поверхности изделия. Её тщательно зачищают механическими и химическими методами.От качества этой процедуры зависит конечный результат и надёжность образованной плёнки.Большое значение это имеет при пассивации цветных металлов: латуни, меди, бронзы.
Электрохимическая
Этот вид пассивации основан на принципах, заложенных в технике гальванической обработки изделий. Ускорение обработки осуществляется благодаря воздействию постоянного тока, который протекает через раствор, ускоряя химическую реакцию. Такая пассивация называется электрохимическая.
В состав такой установки кроме ванны, в котором размещают электролит, используется источник постоянного тока, соединительные провода и один электрод. Вторым электродом является сама деталь.Другим вариантом контактов являются один электрод и корпус ванной (она должна быть изготовлена из металла, стойкого к воздействию электролита и электрического тока). На практике применяют электрические установки с относительно невысоким уровнем напряжения. Его величина не превышает 12В.
В обоих случаях при включении установки через раствор пропускают электрический ток. Он является стимулятором протекания процесса пассивации на поверхности заготовки. На практике различаю анодную и катодную пассивацию.
При такой пассивации положительный потенциал подается на заготовку, а отрицательный — на корпус ванны. При использовании электрохимического способа защитная пленка образуется быстрее и получается более ровной. Но такая технология дороже химической пассивации, т. к. в ней применяется более сложное оборудование и происходит расход электроэнергии.Под его действием защитная пленка получается равномерной. Именно так формируется плёнка на поверхности медных заготовок. Ток пропускают через растворы с растворёнными в них солями хрома. Именно в них медь приобретает наибольшую стойкость к коррозии.
Важными параметрами в этом процессе является время протекания пассивации, плотность и состав электролита, критическая величина тока пассивации. Эти параметры рассчитаны для различных металлов и приведены в специальных таблицах. На основании этих данных рассчитывают допустимое время обработки.
Свойства металла после обработки
Основной задачей пассивации является улучшение физико-химических и механических характеристик поверхностного слоя материала, из которого изготовлена деталь. Остальные характеристики более глубоких слоёв сохраняются неизменными. Поэтому после завершения пассивации в поверхностном слое изменяются следующие свойства и характеристики:
- возникает слой с новым химическим составом;
- изменяется антикоррозийная активность (она значительно замедляется);
- улучшаются физические характеристики материала (только поверхностного слоя);
- в отдельных случаях повышается механическая прочность изделия;
- изменяется цвет детали (она приобретает более эстетичную форму);
- повышаются потребительские свойства, и улучшается товарный вид.
Пассивация нержавеющей стали позволяет значительно повысить антикоррозийные свойства и придать готовой детали совершенно другой цвет. Применение хрома или никеля в составе пассивирующего раствора позволяет получить блестящий металлический цвет.
Пассивация железа близкими к нему химическими элементами позволяет создать достаточно стойкий к коррозии внешний слой. Таки образом расширяется область применения таких изделий. Их можно использовать даже в активных и агрессивных средах. Кроме различных марок стали пассивации подвергают чугун. Основной задачей является создание защитной плёнки от коррозии. В отдельных случаях при применении загущенного нитрата натрия поверхностный слой приобретает некоторую эластичность. В этом случае добиваются снижения хрупкости всей детали. Одним из видов стали является так называемое воронение. В результате обработки получается надёжный внешний слой чёрного цвета
Аналогичным образом изменяются свойства поверхностного слоя цветных металлов. В результате пассивации образуются определённой толщины адсорбционные или фазовые слои. Помещение заготовки из алюминия стимулирует процесс естественной пассивации поверхностного слоя этого металла. При воздействии кислотных растворов защитные свойства поверхностного слоя алюминия увеличиваются.