Содержание
- Медь, свойства, соединения, сплавы, производство, применение
- Химические свойства меди
- Соединения меди
- Получение и применение меди
- Физические свойства. Медь, серебро. Оксиды меди (I) и (II), оксид серебра (I)
- Меди (I) оксид
- Физико-химические свойства.
- Меди (I) оксид купить
- Применение.
- Оксид меди (II), — Copper(II) oxide
- содержание
- производство
- Структура и физические свойства
Окись меди применение
Медь, свойства, соединения, сплавы, производство, применение
Медь
Медь (лат. Cuprum) — химический элемент I группы периодической системы Менделеева (атомный номер 29, атомная масса 63,546). В соединения медь обычно проявляет степени окисления +1 и +2, известны также немногочисленные соединения трехвалентной меди. Важнейшие соединения меди: оксиды Cu2O, CuO, Cu2O3; гидроксид Cu(OH)2, нитрат Cu(NO3)2 . 3H2O, сульфид CuS, сульфат(медный купорос) CuSO4 . 5H2O, карбонат CuCO3Cu(OH)2, хлорид CuCl2 . 2H2O.
Медь — один из семи металлов, известных с глубокой древности. Переходный период от каменного к бронзовому веку (4 — 3-е тысячелетие до н.э.) назывался медным веком или халколитом (от греческого chalkos — медь и lithos — камень) или энеолитом (от латинского aeneus — медный и греческого lithos — камень). В этот период появляются медные орудия. Известно, что при возведении пирамиды Хеопса использовались медные инструменты.
Чистая медь — ковкий и мягкий металл красноватого, в изломе розового цвета, местами с бурой и пестрой побежалостью, тяжелый (плотность 8,93 г/см 3 ), отличный проводник тепла и электричества, уступая в этом отношении только серебру (температура плавления 1083 °C). Медь легко вытягивается в проволоку и прокатывается в тонкие листы, но сравнительно мало активна. В сухом вохдухе и кислороде при нормальных условиях медь не окисляется. Но она достаточно легко вступает в реакции: уже при комнатной температуре с галогенами, например с влажным хлором образует хлорид CuCl2, при нагревании с серой образует сульфид Cu2S, с селеном. Но с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют, например, соляная и разбавленная серная кислоты. Но в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соотвествующих солей: 2Cu + 4HCl + O2 = 2CuCl2 + 2H2O.
В атмосфере, содержащей CO2, пары H2O и др., покрывается патиной — зеленоватой пленкой основного карбоната (Cu2(OH)2CO3)), ядовитого вещества.
Медь входит более чем в 170 минералов, из которых для промышленности важны лишь 17, в том числе: борнит (пестрая медная руда — Cu5FeS4), халькопирит (медный колчедан — CuFeS2), халькозин (медный блеск — Cu2S), ковеллин (CuS), малахит (Cu2(OH)2CO3). Встречается также самородная медь.
Плотность меди, удельный вес меди и другие характеристики меди
Плотность — 8,93*10 3 кг/м 3 ;
Удельный вес — 8,93 г/cм 3 ;
Удельная теплоемкость при 20 °C — 0,094 кал/град;
Температура плавления — 1083 °C ;
Удельная теплота плавления — 42 кал/г;
Температура кипения — 2600 °C ;
Коэффициент линейного расширения (при температуре около 20 °C) — 16,7 *10 6 (1/град);
Коэффициент теплопроводности — 335ккал/м*час*град;
Удельное сопротивление при 20 °C — 0,0167 Ом*мм 2 /м;
Модули упругости меди и коэффициент Пуассона
СОЕДИНЕНИЯ МЕДИ
Оксид меди (I) Cu2O3 и закись меди (I) Cu2O, как и другие соединения меди (I) менее устойчивы, чем соединения меди (II). Оксид меди (I), или закись меди Cu2O в природе встречается в виде минерала куприта. Кроме того, она может быть получена в виде осадка красного оксида меди (I) в результате нагревания раствора соли меди (II) и щелочи в присутствии сильного восстановителя.
Оксид меди (II), или окись меди, CuO — черное вещество, встречающееся в природе (например в виде минерала тенерита). Его получают прокаливанием гидроксокарбоната меди (II) (CuOH)2CO3 или нитрата меди (II) Cu(NO2)2.
Оксид меди (II) хороший окислитель. Гидроксид меди (II) Cu(OH)2 осаждается из растворов солей меди (II) при действии щелочей в виде голубой студенистой массы. Уже при слабом нагревании даже под водой он разлагается, превращаясь в черный оксид меди (II).
Гидроксид меди (II) — очень слабое основание. Поэтому растворы солей меди (II) в большинстве случаев имеют кислую реакцию, а со слабыми кислотами медь образует основные соли.
Сульфат меди (II) CuSO4 в безводном состоянии представляет собой белый порошок, который при поглощении воды синеет. Поэтому он применяется для обнаружения следов влаги в органических жидкостях. Водный раствор сульфата меди имеет характерный сине-голубой цвет. Эта окраска свойственна гидратированным ионам [Cu(H2O)4] 2+ , поэтому такую же окраску имеют все разбавленные растворы солей меди (II), если только они не содердат каких-либо окрашенных анионов. Из водных растворов сульфат меди кристаллизуется с пятью молекулами воды, образуя прозрачные синие кристаллы медного купороса. Медный купорос применяется для электролитического покрытия металлов медью, для приготовления минеральных красок, а также в качестве исходного вещества при получении других соединений меди. В сельском хозяйстве разбавленный раствор медного купороса применяется для опрыскивания растений и протравливания зерна перед посевом, чтобы уничтожить споры вредных грибков.
Хлорид меди (II) CuCl2 . 2H2O. Образует темно-зеленые кристаллы, легко растворимые в воде. Очень концентрированные растворы хлорида меди (II) имеют зеленый цвет, разбавленные — сине-голубой.
Нитрат меди (II) Cu(NO3)2 . 3H2O. Получается при растворении меди в азотной кислоте. При нагревании синие кристаллы нитрата меди сначала теряют воду, а затем легко разлагаются с выделением кислорода и бурого диоксида азота, переходя в оксид меди (II).
Гидроксокарбонат меди (II) (CuOH)2CO3. Встречается в природе в виде минерала малахита, имеющего красивый изумрудно-зеленый цвет. Искусственно приготовляется действием Na2CO3 на растворы солей меди (II).
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2↑
Применяется для получения хлорида меди (II), для приготовления синих и зеленых минеральных красок, а также в пиротехнике.
Ацетат меди (II) Cu (CH3COO)2 . H2O. Получается обработкой металлической меди или оксида меди (II) уксусной кислотой. Обычно представляет собой смесь основных солей различного состава и цвета (зеленого и сине-зеленого). Под названием ярь-медянка применяется для приготовления масляной краски.
Комплексные соединения меди образуются в результате соединения двухзарядных ионов меди с молекулами аммиака.
Из солей меди получают разноообразные минеральные краски.
Все соли меди ядовиты. Поэтому, чтобы избежать образования медных солей, медную посуду покрывают изнутри слоем олова (лудят).
ПРОИЗВОДСТВО МЕДИ
Медь добывают из оксидных и сульфидных руд. Из сульфидных руд выплавляют 80% всей добываемой меди. Как правило, медные руды содержат много пустой породы. Поэтому для получения меди используется процесс обогащения. Медь получают методом ее выплавки из сульфидных руд. Процесс состоит из ряда операций: обжига, плавки, конвертирования, огневого и электролитического рафинирования. В процессе обжига большая часть примесных сульфидов превращается в оксиды. Так, главная примесь большинства медных руд пирит FeS2 превращается в Fe2O3. Газы, образующиеся при обжиге, содержат CO2, который используется для получения серной кислоты. Получающиеся в процессе обжига оксиды железа, цинка и других примесей отделяются в виде шлака при плавке. Жидкий медный штейн (Cu2S с примесью FeS) поступает в конвертор, где через него продувают воздух. В ходе конвертирования выделяется диоксид серы и получается черновая или сырая медь. Для извлечения ценных (Au, Ag, Te и т.д.) и для удаления вредных примесей черновая медь подвергается сначала огневому, а затем электролитическому рафинированию. В ходе огневого рафинирования жидкая медь насыщается кислородом. При этом примеси железа, цинка и кобальта окисляются, переходят в шлак и удаляются. А медь разливают в формы. Получающиеся отливки служат анодами при электролитическом рафинировании.
Основным компонентом раствора при электролитическом рафинировании служит сульфат меди — наиболее распространенная и дешевая соль меди. Для увеличения низкой электропроводности сульфата меди в электролит добавляют серную кислоту. А для получения компактного осадка меди в раствор вводят небольшое количество добавок. Металлические примеси, содержащиеся в неочищенной («черновой») меди, можно разделить на две группы.
1)Fe, Zn, Ni, Co. Эти металлы имеют значительно более отрицательные электродные потенциалы, чем медь. Поэтому они анодно растворяются вместе с медью, но не осаждаются на катоде, а накапливаются в электролите в виде сульфатов. Поэтому электролит необходимо периодически заменять.
2)Au, Ag, Pb, Sn. Благородные металлы (Au, Ag) не претерпевают анодного растворения, а в ходе процесса оседают у анода, образуя вместе с другими примесями анодный шлам, который периодически извлекается. Олово же и свинец растворяются вместе с медью, но в электролите образуют малорастворимые соединения, выпадающие в осадок и также удаляемые.
СПЛАВЫ МЕДИ
Сплавы, повышающие прочность и другие свойства меди, получают введением в нее добавок, таких, как цинк, олово, кремний, свинец, алюминий, марганец, никель. На сплавы идет более 30% меди.
Латуни — сплавы меди с цинком ( меди от 60 до 90% и цинка от 40 до 10%) — прочнее меди и менее подвержены окислению. При присадке к латуни кремния и свинца повышаются ее антифрикционные качества, при присадке олова, алюминия, марганца и никеля возрастает антикоррозийная стойкость. Листы, литые изделия используются в машиностроении, особенно в химическом, в оптике и приборостроении, в производстве сеток для целлюлознобумажной промышленности.
Бронзы. Раньше бронзами называли сплавы меди (80-94%) и олова (20-6%). В настоящее время производят безоловянные бронзы, именуемые по главному вслед за медью компоненту.
Алюминиевые бронзы содержат 5-11% алюминия, обладают высокими механическими свойствами в сочетании с антикоррозийной стойкостью.
Свинцовые бронзы, содержащие 25-33% свинца, используют главным образом для изготовления подшипников, работающих при высоких давлениях и больших скоростях скольжения.
Кремниевые бронзы, содержащие 4-5% кремния, применяют как дешевые заменители оловянных бронз.
Бериллиевые бронзы, содержащие 1,8-2,3% бериллия, отличаются твердостью после закалки и высокой упругостью. Их применяют для изготовления пружин и пружинящих изделий.
Кадмиевые бронзы — сплавы меди с небольшим количества кадмия (до1%) — используют для изготовления арматуры водопроводных и газовых линий и в машиностроении.
Припои — сплавы цветных металлов, применяемые при пайке для получения монолитного паяного шва. Среди твердых припоев известен медносеребряный сплав (44,5-45,5% Ag; 29-31%Cu; остальное — цинк).
ПРИМЕНЕНИЕ МЕДИ
Медь, ее соединения и сплавы находят широкое применение в различных отраслях промышленности.
В электротехнике медь используется в чистом виде: в производстве кабельных изделий, шин голого и контактного проводов, электрогенераторов, телефонного и телеграфного оборудования и радиоаппаратуры. Из меди изготавливают теплообменники, вакуум-аппараты, трубопроводы. Более 30% меди идет на сплавы.
Сплавы меди с другими металлами используют в машиностроении, в автомобильной и тракторной промышленности (радиаторы, подшипники), для изготовления химической аппаратуры.
Высокая вязкость и пластичность металла позволяют применять медь для изготовления разнообразных изделий с очень сложным узором. Проволока из красной меди в отожженном состоянии становится настолько мягкой и пластичной, что из нее без труда можно вить всевозможные шнуры и выгибать самые сложные элементы орнамента. Кроме того, проволока из меди легко спаивается сканым серебряным припоем, хорошо серебрится и золотится. Эти свойства меди делают ее незаменимым материалом при производстве филигранных изделий.
Коэффициент линейного и объемного расширения меди при нагревании приблизительно такой же , как у горячих эмалей, в связи с чем при остывании эмаль хорошо держится на медном изделии, не трескается , не отскакивает. Благодаря этому мастера для производства эмалевых изделий предпочитают медь всем другим металлам.
Как и некоторые другие металлы, медь входит в число жизненно важных микроэлементов. Она участвует в процессе фотосинтеза и усвоении растениями азота, способствует синтезу сахара, белков, крахмала, витаминов. Чаще всего медь вносят в почву в виде пятиводного сульфата — медного купороса CuSO4 . 5H2O. В большом количестве он ядовит, как и многие другие соединения меди, особенно для низших организмов. В малых же дозах медь необходима всему живому.
Медь (купрум, свое название получила в честь острова Кипр, где было открытое крупное медное месторождение) является одним из первых металлов, который освоил человек — Медный век (эпоха, когда в обиходе человека преобладали медные орудия) охватывает период IV—III тысячелетия до н. э.
Сплав меди с оловом (бронза) был получен на Ближнем Востоке за 3000 лет до н. э. Бронза была предпочтительней меди, поскольку была более прочна и лучше поддавалась ковке.
Среднее содержание меди в земной коре составляет 4,7-5,5·10 -3 % по массе. Медь присутствует в природе, как в виде самородков, так и в соединений, наибольшее промышленное значение из которых имеют медный колчедан (CuFeS2), халькозин Cu2S и борнит Cu5FeS4. Разработка медных месторождений ведется открытым способом.
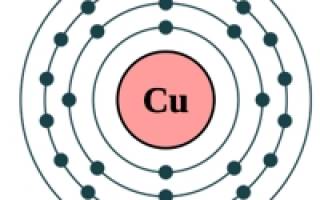
Рис. Строение атома меди.
Электронная конфигурация атома меди — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 (см. Электронная структура атомов). У меди один спаренный электрон с внешнего s-уровня «перескакивает» на d-подуровень предвнешней орбитали, что связано с высокой устойчивостью полностью заполненного d-уровня. Завершенный устойчивый d-подуровень меди обусловливает ее относительную химическую инертность (медь не реагирует с водородом, азотом, углеродом, кремнием). Медь в соединениях может проявлять степени окисления +3, +2, +1 (наиболее устойчивые +1 и +2).
Рис. Электронная конфигурация меди.
Физические свойства меди:
- металл, красно-розового цвета;
- обладает высокой ковкостью и пластичностью;
- хорошей электропроводностью;
- малым электрическим сопротивлением.
Химические свойства меди
- при нагревании реагирует с кислородом:
O2 + 2Cu = 2CuO; - при длительном пребывании на воздухе реагирует с кислородом даже при комнатной температуре:
O2 + 2Cu + CO2 + H2O = Cu(OH)2·CuCO3; - вступает в реакции с азотной и концентрированной серной кислотой:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O; - с водой, растворами щелочей, соляной и разбавленной серной кислотой медь не реагирует.
Соединения меди
Оксид меди CuO (II):
- твердое вещество красно-коричневого цвета, не растворимое в воде, проявляет основные свойства;
- при нагревании в присутствии восстановителей дает свободную медь:
CuO + H2 = Cu + H2O; - оксид меди получают взаимодействием меди с кислородом или разложением гидроксида меди (II):
O2 + 2Cu = 2CuO; Cu(OH)2 = CuO + H2O.
Гидроксид меди Cu(OH2)(II):
- кристаллическое или аморфное вещество голубого цвета, нерастворимое в воде;
- разлагается на воду и оксид меди при нагревании;
- реагирует с кислотами, образуя соответствующие соли:
Cu(OH2) + H2SO4 = CuSO4 + 2H2O; - реагирует с растворами щелочей, образуя купраты — комплексные сооединения ярко-синего цвета:
Cu(OH2) + 2KOH = K2[Cu(OH)4].
Более подробно о соединениях меди см. Оксиды меди.
Получение и применение меди
- пирометаллургическим методом медь получают из сульфидных руд при высоких температурах:
CuFeS2 + O2 + SiO2 → Cu + FeSiO3 + SO2; - оксид меди восстанавливается до металлической меди водородом, угарным газом, активными металлами:
Cu2O + H2 = 2Cu + H2O;
Cu2O + CO = 2Cu + CO2;
Cu2O + Mg = 2Cu + MgO.
Применение меди обусловливается ее высокой электро- и теплопроводностью, а также пластичностью:
- изготовление электрических проводов и кабелей;
- в теплообменной аппаратуре;
- в металлургии для получения сплавов: бронзы, латуни, мельхиора;
- в радиоэлектронике.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки:
Политика конфиденциальности Об авторе
Физические свойства. Медь, серебро. Оксиды меди (I) и (II), оксид серебра (I)
Медь, серебро. Оксиды меди (I) и (II), оксид серебра (I). Гидроксид меди (II). Соли серебра и меди. Комплексные соединения серебра и меди
Медь
Медь Cu — химический элемент I группы побочной подгруппы периодической системы Д. И. Менделеева; атомный номер 29, атомная масса 63,546. Электронная конфигурация предвнешнего и внешнего электронных слоев меди выглядит следующим образом — 3s 2 3p 6 3d 10 4s l . Медь — типичный металл, поэтому ее атомы связаны между собой металлической связью. Элемент представляет собой смесь двух изотопов с массовыми числами 63 (69,1%) и 65 (30,9%).
Распространенность в природе
Содержание меди в земной коре составляет 0,005%, что позволяет ей занимать лишь 23-е место среди всех элементов. Самородная медь в наше время составляет незначительную часть от общего производства металлов.
Подавляющая часть меди присутствует в горных породах в виде соединений. Из сотен минералов меди промышленное значение имеют немногие, в частности халькопирит — медный колчедан CuFeS2, халькозин — медный блеск Cu2S, ковеллин — CuS, малахит — CuСО3•Cu(ОН)2 и азурит — 2CuСO3•Cu(ОН)2.
Физические свойства
Медь — тяжелый розово-красный металл, мягкий и ковкий, плавится при температуре 1083°С, очень хорошо проводит электрический ток и теплоту: электрическая проводимость меди в 1,7 раза выше, чем алюминия, в 6 раз выше железа и лишь немного уступает электрической проводимости серебра.
Медь, серебро и золото составляют побочную подгруппу I группы периодической системы Менделеева. С щелочными металлами их сближает лишь способность образовывать одновалентные катионы. Для меди и ее аналогов характерно то, что они
могут давать соединения с валентностью, превышающей номер своей группы. Кроме того, элементы подгруппы меди, в отличие от щелочных металлов, склонны к комплексообразованию, образуют окрашенные соли, т.е. проявляют свойства, сближающие
их с никелем, палладием и платиной (побочная подгруппа VIII
Такое поведение Cu, Ag, Au объясняется конфигурацией внешних электронных оболочек их атомов. У атома меди самая подвижная наружная (4-я от ядра) оболочка содержит один s-электрон, ему предшествует десять d-электронов третьей от ядра оболочки (конфигурация 3d 10 4s 1 ).
Атомы меди и ее аналогов могут при образовании соединений терять не только самый внешний s-электрон, но и один или два d-электрона предшествующей оболочки, проявляя более высокую степень окисления. Для меди степень окисления +2 (валентность II) более характерна, чем +1 (валентность I).
Медь химически малоактивна и в чистом сухом воздухе не изменяется. Однако атмосфера, в которой мы живем, содержит водяные пары и углекислый газ, поэтому со временем медь покрывается зеленоватым налетом основного карбоната меди:
При прокаливании на газовой горелке медь покрывается черным налетом оксида меди (II) CuO: 2Cu+O2=2CuO
Но если быстро опустить в воду раскаленный докрасна кусок меди, то на его поверхности образуется ярко-красная пленка Cu2O:
Фтор, хлор, бром реагируют с медью, образуя соответствующие галогениды двухвалентной меди:
При взаимодействии иода с нагретым порошком меди получается иодид одновалентной меди:
Медь горит в парах серы:
В электрохимическом ряду напряжений металлов медь стоит правее водорода. Она не взаимодействует с водой, растворами щелочей, соляной и разбавленной серной кислотой. Однако в кислотах — сильных окислителях (например, азотной и концентрированной серной) медь растворяется:
Медь растворяет водород, который существенно ухудшает ее механические свойства («водородная болезнь» меди).
Получение
Исходным сырьем для промышленного получения меди служат главным образом сульфидные руды, при этом считается рентабельным перерабатывать породы, содержащие более 1 % металла. Процесс получения меди из сульфидных руд относят к пирометаллургическим (протекающим при высокой температуре). Его можно упрощенно представить следующим образом: вначале сульфид меди (Cu2S) подвергают окислительному обжигу:
К образовавшемуся оксиду меди (II) добавляют новую порцию сульфида. При высокой температуре протекает реакция:
Таким способом получают черновую медь (97-98% Си).
Применение
Высокая электро- и теплопроводность меди, ее пластичность и коррозионная стойкость определили направление использования металла в промышленности. Больше половины всей добываемой меди идет на производство электрических проводов. Так, чтобы передать трехфазный переменный ток на расстояние 1 км тремя медными проводами диаметром по 2 мм, необходимо 84 кг меди. В электровакуумной технике употребляется так называемая бескислородная (вакуумная) медь высокой чистоты. В технике сильных токов из меди изготавливают проводники с сечениями различной формы.
Высокая теплопроводность и сопротивление коррозии позволяют изготовлять из меди ответственные детали теплообменников, холодильников, вакуумных аппаратов, трубопроводов для перекачки масел и топлива и т.д. Что касается современного автомобиля, то он содержит 10-15 кг меди: из меди и ее сплавов делают радиаторы, маслоохладители, проводники тока.
Около 30-40% меди используют в виде различных сплавов.
Соединения меди обладают высокой биологической активностью. Они содержатся в животных и растительных организмах. В растениях медь участвует в процессах синтеза хлорофилла, поэтому она входит в качестве одного из компонентов в состав мик-
роудобрений. Медь входит в состав многих продуктов, которые человек использует в пищу, например, в молоко. Недостаточное употребление меди может привести к различным заболеваниям, в частности, ухудшается состав крови. Однако избыток соединений меди также вреден — он может привести к тяжелым отравлениям. Поэтому не рекомендуется пользоваться при приготовлении пищи медной посудой: при кипячении в ней в раствор может перейти избыточное количество меди. Можно лишь использовать медную посуду, покрытую внутри слоем олова.
15.2. Соединения меди: оксид меди (I) и (II), гидроксид меди (II). Соли и комплексные
Соединения меди
Оксид меди (I) Cu2O. Если погрузить в холодную воду раскаленный докрасна кусок меди, то на его поверхности образуется ярко-красная пленка Cu2O. Обычные образцы меди содержат сотые доли Си2О. При нагревании такого металла в атмосфере, содержащей водородные и некоторые другие газы (СО, СН4), происходит восстановление Cu2O:
Образовавшиеся пары воды и углекислый газ выделяются из металла, вызывая появление трещин. А это резко ухудшает механические свойства меди.
Соединения меди (I) менее устойчивы, чем соединения меди (II); в водных растворах они легко подвергаются диспропорционированию (реакции самоокисления-самовосстановления):
Оксид меди (II) CuO представляет собой кристаллы черного цвета. Его обычно получают из металлической меди путем прокаливания на воздухе, а также разложения солей, например:
Оксид меди (II) — основной оксид, при обычных условиях весьма устойчивый. При небольшом нагревании он довольно
легко восстанавливается водородом или углеродом до металлической меди:
С водой оксид меди (II) не реагирует, поэтому соответствующее основание — гидроксид меди Cu(ОН)2 — не образуется путем взаимодействия оксида с водой.
Гидроксид меди (II) Cu(ОН)2 выпадает в виде объемистого голубого осадка при действии щелочей на растворы солей двухвалентной меди:
Это слабое нерастворимое основание, легко вступает во взаимодействие с кислотами с образованием солей:
Свежеосажденный гидроксид меди (II) Cu(OH)2 растворяется и в концентрированных растворах щелочей, но его кислотный характер выражен слабо:
Гидроксид меди (II) Cu(ОН)2 легко растворяется в водных растворах аммиака, образуя раствор ярко-синего цвета. Этот раствор нередко применяют в органической химии для разного рода качественных реакций, а также иногда для обработки целлюлозы:
Гидроксид меди (II) Cu(ОН)2 разлагается при нагревании выше 70-90°С:
При этом он чернеет, постепенно превращаясь в оксид меди (II)CuO.
. Соли меди (II) нашли широкое применение в народном хозяйстве. Особенно важным является медный купорос — кристаллогидрат сульфата меди (II) CuSO4•5Н2О. Медный купорос используется в производстве минеральных и органических красителей, в медицинской промышленности, для пропитки древесины в качестве антисептика (предохраняет дерево от гниения). Большое значение имеет медный купорос в сельском хозяйстве: им про-
травливают семена перед посевом, опрыскивают деревья и кустарники для борьбы с вредителями.
Для ионов меди (II) Cu 2+ характерно образование комплексных соединений, например K2[Cu(CN)4] — тетрацианокупрат (II) калия:
Из других комплексных соединений меди (II) отметим соединение с аммиаком. Если к раствору хлорида меди (II) прилить небольшое количество раствора аммиака, то выпадет осадок гидроксида меди (II):
Если добавить избыток аммиака, то гидроксид растворится с образованием комплексного соединения темно-синей окраски, характерной для аммиачного комплекса меди:
Эта реакция является качественной на ион меди (II). Растворимость гидроксида меди (II) в щелочах также связана собразованием комплексных соединений: Cu(OH)2+2NaOH=Na2[Cu(OH)4]
Образованием комплексных соединений объясняется цвет растворов солей меди (II).
Безводный сульфат меди — вещество белого цвета, а раствор этой соли имеет голубую окраску.
При растворении происходит химическое взаимодействие ионов соли с водой, и образуются так называемые аквакомплексы меди, имеющие голубую окраску:
Меди (I) оксид
Меди (I) оксид (медь (I) окись, медь закись, оксид меди 1, куприт) — гемиоксид металла меди.
Физико-химические свойства.
Формула — Cu2O. Внешний вид — караминово-красный порошок. Температура плавления 1235°C. Плотность 6,0 г/см 3 . Не растворим в воде и не реагирует с ней, заметно взаимодействует с NaOH и KOH. Растворяется в водных растворах аммонийных солей. Не растворим в этаноле и органических растворителях. При нагревании на воздухе окисляется кислородом воздуха с образованием CuO. Вызывает коррозию алюминия. Токсичен; ПДК в воздухе рабочей зоны 0,1 мг/м 3 , в атмосфере 0,003 мг/м 3 , в воде 0,1 мг/л.
Оксид меди 1 растворяется в разбавленной серной кислоте, образуя при этом медь и меди сульфат. В водных растворах NH3 образует аммиакат [Cu(NH3 )4](OH)2. В реакциях с HBr образует Cu Br. В реакциях с HI образует Cu I .
Меди (I) оксид купить
Цена, которая указана ниже, является ориентировочной. Возможность купить товар по этой цене уточняйте.
Применение.
Оксид одновалентной меди применяется меди при изготовлении корабельных красок морских судов для предотвращения обрастания (обладает фунгицидными свойствами — убивает низших морских животных). При изготовлении керамики и эмалей оксид меди (I) применяется в качестве красного пигмента. Меди гемиоксид используется для синтеза различных солей меди и в качестве катализатора в производстве органических веществ. Он также находит применение в гальванотехнике и производстве выпрямителей электрического тока (является полупроводником).
Применение меди закиси в технологии красок.
Меди (I) оксид применяют в качестве пигмента для необрастающих составов красок, которые служат для защиты подводных частей судов, плавучих доков и портовых сооружений от обрастания морской флорой и фауной. Обрастание подводных частей судов наносит большой ущерб судоходству, так как приводит к уменьшению скорости корабля, значительному увеличению расхода топлива и вызывает необходимость частой постановки судна в док для его очистки.
Обрастание поверхностей, обработанных необрастающими составами, начинается значительно позднее и протекает не так интенсивно, как обрастание неокрашенных поверхностей. Действие этих составов обусловлено наличием в них токсичных веществ, которые вызывают гибель растительных и животных микроорганизмов. Медь убивает простейшие водоросли уже при концентрации 1×10 -4 г/л. Медь переходит в ионное состояние за счет химической реакции с морской водой, при этом образуется водорастворимая соль CuCl2×6NaCl.
Применение меди закиси в сельском хозяйстве.
Меди (I) оксид применяют для защиты сельскохозяйственных растений в составах некоторых фунгицидов. Активность таких фунгицидов основана на способности ионов меди взаимодействовать с сульфгидрильными группами ферментов и коферментов, а также с аминогруппами грибной клетки, вызывая осаждение, или денатурацию белков. Кроме того, являясь сильными окислителями, эти фунгициды могут ускорять внутриклеточные окислительные процессы.
Важная роль в фунгитоксичности принадлежит сорбционной способности протоплазмы клеток грибов и переходов ионов меди в раствор из осадка на листьях. Растворенная медь адсорбируется спорами, равновесие нарушается, и часть меди снова переходит в растворимое состояние. Процесс протекает до тех пор, пока спора не кумулирует токсическую дозу. Переводу меди в раствор способствует углекислота, аммонийные соли и другие вещества, присутствующие в атмосфере, осадках, росе, выделениях листьев, спор грибов.
Фунгицидные препараты содержат около 50% действующего вещества (меди (I) оксид) и минерально масляную эмульсию на основе вазелинового масла. Обработку растений такими препаратами проводят по технологии ультрамалообъемного опрыскивания (около 10 л/га). Доза 1,9÷4,6 кг действующего вещества на гектар предназначается для защиты винограда от мильдью, сахарной свеклы от цероспороза и других растений от различных заболеваний. Относительно безопасен для пчел и рыб. Повреждает отдельные сорта и культуры, в том числе из семейства крестоцветных, чувствительных к медьсодержащим препаратам.
В промышленности получают электролизом водных растворов натрия хлорида с применением медных электродов при температуре до 70°C.
В лабораториях получают нагреванием CuO при температуре до 1100°C или методом восстановления из водного раствора медного купороса в присутствии глюкозы.
Оксид меди (II), — Copper(II) oxide
- 1317-38-0Y
- CHEBI: 75955N
- ChEMBL1909057N
- 144499Y
- V1XJQ704R4Y
Оксид меди (II) , или оксид меди представляет собой неорганическое соединение с формулой CuO. Черное твердое вещество, это один из двух стабильных оксидов из меди , другой Cu 2 O или оксид меди . В качестве минерала, он известен как тенорита . Это продукт добычи меди и предшественник многих других медьсодержащих продуктов и химические соединения.
содержание
производство
Он производится в больших масштабах с помощью пирометаллургии , используемой для извлечения меди из руд. Эти руды обрабатывают водную смесь карбоната аммония, аммиак и кислород с получением меди (I) и меди (II) аммиакатные комплексов , которые извлекаются из твердых частиц. Эти комплексы разлагаются с паром с получением CuO.
Он может быть образован путем нагрева меди на воздухе при температуре около 300 — 800 ° C:
2 Cu + O 2 → 2 CuO
Для лаборатории использует оксид чистой меди (II) , лучше получают нагревание меди (II) , нитрат , меди (II) , гидроксид или основную медь (II) , карбонат :
2 Cu (NO 3 ) 2 (с) → 2 CuO (тв) + 4 NO 2 (г) + O 2 (г) (180 ° С) Cu (OH) 2 (с) → CuO (ы) + Н 2 О (л) (80-100 ° С) Cu 2 CO 3 (ОН) 2 (с) → 2CuO (ы) + CO 2 (г) + H 2 O (г) (290 ° С)
Медь (II) , оксид растворяется в минеральных кислот , таких как соляная кислота , серная кислота или азотная кислота , с получением соответствующего меди (II) соли:
Он вступает в реакцию с концентрированной щелочью с образованием соответствующих солей купратов:
Она также может быть сведена к меди металла , используя водород , окись углерода , или углерод :
CuO + Н 2 → Cu + H 2 O CuO + CO → Cu + СО 2 2CuO + C → 2Cu + СО 2
Когда оксид меди заменяются на оксид железа в термитном полученной смесью является низким взрывчатым веществом, не зажигательно.
Структура и физические свойства
Оксид меди (II) принадлежит к моноклинной кристаллической системе . Атом меди координирует 4 атомов кислорода в приблизительно квадратной плоской конфигурации.
Работа объемной CuO составляет 5,3 эВ
Оксид меди (II) представляет собой полупроводник р-типа , с узкой шириной запрещенной зоны 1,2 эВ. Оксид меди может быть использован для производства сухой батареи элементов .
В качестве существенного продукта добычи меди, оксид меди (II), является отправной точкой для производства других солей меди. Например, многие консерванты древесины получают из оксида меди.
Оксид меди используются в качестве пигмента в керамике , чтобы произвести синие, красные и зеленый, а иногда серые, розовые или черные глазури.
Он также неправильно используется в качестве пищевой добавки в корм для животных. Из-за низкой биологической активностью, пренебрежимо мало меди поглощается.
Он также используется при сварке медных сплавов .
Использование в распоряжении
Оксид меди может быть использован для безопасного удаления опасных материалов , таких как цианидов , углеводороды , галогенированные углеводороды и диоксины , путем окисления .
Реакции разложения фенола и пентахлорфенола следующих путей:
С 6 Н 5 ОН + 14CuO → 6CO 2 + 3H 2 O + 14Cu С 6 Cl 5 ОН + 2H 2 O + 9CuO → 6CO 2 + 5HCl + 9Cu