Содержание
- 2.3. Типы кристаллических решеток
- Кристаллическое строение металлов. Характерные свойства металлов. Виды кристаллических решеток, дефекты их строения.
- Кристаллические решетки. Типы кристаллических решеток.
- Типы кристаллических решеток.
- Металлическая связь в кристаллических решетках.
- Как «упаковывается» один слой кристаллической решетки?
- Как «упаковываются» слои кристаллической решетки?
- Примеры кристаллических решеток.
- Ионная связь кристаллических решеток.
- Молекулярная связь кристаллических решеток.
- Макромолекулярная связь кристаллических решеток.
- 2.3. Типы кристаллических решеток
- Типы кристаллических решеток
- Презентация к уроку
- Ход урока
Виды кристаллических решеток металлов
2.3. Типы кристаллических решеток
Идеальную кристаллическую решетку можно построить путем многократного повторения с последовательной трансляцией (переносом в пространстве) в трех направлениях кристаллических элементарных ячеек, которые являются первичными звеньями кристаллической решетки.
Элементарная ячейка — это наименьший объем кристалла, который еще передает характерные особенности кристаллической решетки. Элементарная кристаллическая ячейка представляет собой элементарный параллелепипед, ребра которого принимают за оси координат кристалла (х, у, z), а наименьшие расстояния между узлами кристаллической решетки (стороны элементарного параллелепипеда) вдоль осей х, у, z обозначаются соответственно а, Ь, с и называются параметрами, или периодами, решетки. Если кристаллическая решетка кубическая, то ее параметры (периоды) вдоль всех трех осей равны, т. е. а = b = с. Геометрически возможно существование 14 типов кристаллических решеток.
По расположению атомов в элементарной ячейке кристаллические решетки подразделяют на простые и сложные.
В простых (примитивных) решетках атомы располагаются только по вершинам ячейки, т. е. на долю каждой из них приходится один атом.
Сложными являются решетки, в которых на долю каждой ячейки приходится более одного атома. Среди них наиболее часто встречаются следующие тетрагональные решетки:
- • объемноцентрированные, в которых атомы располагаются в вершинах и в центре параллелепипеда;
- • гранецентрированные — решетки с атомами, расположенными в вершинах и центрах всех граней параллелепипеда;
- • базоцентрированные, имеющие атомы в вершинах и центрах противоположных граней параллелепипеда.
Существуют также решетки с гексагональной симметрией.
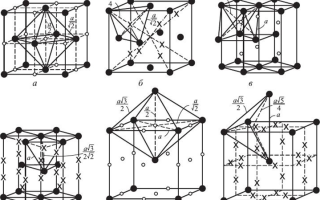
Для промышленных металлов наиболее распространенными являются следующие типы кристаллических решеток (рис. 2.2):
- • кубическая объемноцентрированная (ОЦК-решетка, рис. 2.2, а) (координационное число — число ближайших к данному соседних атомов — равно 8): V, Nb, Сг, Та, Mo, W, a-Fe (при t 882 °С), p-Zr (при t > 862 °С), р-Вс (при t > 1254 *С) и др.;
- • кубическая гранецентрированная (ЩК-решетка, рис. 2.2, б) (координационное число равно 12): Al, Си, Pt, Pb, Ag, Аи, Ni, р-Со (при t > 400 °С), y-Fe (при t = 911-1392 °С), Pd и др.;
- • гексагональная плотноупакованная (ГПУ-решетка, рис. 2.2, в) (координационное число равно 12): Mg, Zn, Hf, Re, a-Ti (при t
Рис. 2.2. Типы наиболее распространенных кристаллических решеток металлов и схемы упаковки атомов: а — объемноцентрированная кубическая, б — гранецентрированная кубическая, в — гексагональная плотноупакованная; показаны индексы некоторых направлений и плоскостей (индицируемые плоскости заштрихованы); а, с — параметры решетки. Пояснения к индицированию плоскостей и направлений см. в разд. 2.4 и 2.5
ГЦК- и ГПУ-решетки являются плогноупакованными, имеют наивысший коэффициент компактности (отношение объема, занимаемого атомами в элементарной ячейке, к ее полному объему), равный 0,74. У ОЦК-решетки коэффициент компактности составляет 0,68. Таким образом, оставшаяся часть объема элементарной ячейки приходится на пустоты между атомами. Различают два типа пустот — октаэдрические и тетраэдрические. Каждая октаэдрическая пустота расположена между шестью атомами решетки, занимающими места в вершинах правильного октаэдра. Каждая тетраэдрическая — между четырьмя атомами решетки, занимающими места в вершинах правильного тетраэдра. На рисунке 2.3 показано положение тетраэдрических и октаэдрических пустот в ГЦК-, ГПУ- и ОЦК-решетках.
Рис. 2.3. Октаэдрические (о) и тетраэдрические (х) пустоты в ГЦК- (а, б),
ГПУ- (в, г) и ОЦК- (д, е) решетках; • — узловые атомы решетки
В октаэдрическую пустоту и ГЦК-, и ГПУ-решетки можно вписать сферу радиусом 0,41 /?, в тетраэдрическую пустоту — 0,22/?, где R — радиус узлового атома решетки. В октаэдрическую пустоту ОЦК-решетки можно вписать сферу радиусом 0,15/?, в тетраэдрическую — 0,29/?.
Заметим, что на каждый атом как ГЦК-, так и ГПУ-решетки приходятся две тетраэдрические и одна октаэдрическая пустота, а на каждый атом ОЦК-решетки — три октаэдрические и шесть тетраэдрических пустот.
Примечательно, что примесные атомы внедрения в ОЦК-решетке (например, углерод, азот в a-железе) могут легко размещаться в меньших по размеру тетраэдрических пустотах, поскольку вокруг октаэдрической пустоты при этом смещаются лишь два узловых атома вдоль ребра куба, т. е. вдоль направления с малой плотностью упаковки атомов. А вокруг тетраэдрической пустоты при внедрении в нее атома примеси смещаются четыре узловых атома в направлениях довольно плотной упаковки. Эта ситуация будет обсуждена ниже (разд. 2.15) при рассмотрении образования атмосфер Снука вокруг дислокаций.
Важнейшие элементарные полупроводники, такие как кремний и германий, имеют кристаллическую структуру типа алмаза, а многие полупроводниковые соединения типа А 2 В 6 или А 3 В 5 (например, CdS, CdTe, GaAs, GaP, InSb, InP, A1P, AlSb, a-ZnS и др.) — структуру типа сфалерита. В этих решетках каждый атом окружен четырьмя соседними, расположенными в вершинах правильного тетраэдра (координационное число равно 4).
На рисунке 2.4 показаны кристаллические решетки алмаза и сфалерита.
Рис. 2.4. Кристаллические решетки алмаза (а) и сфалерита (б)
В решетке алмаза атомы занимают все узлы ГЦК-ячейки, а также центры четырех из восьми октантов, на которые можно мысленно разбить куб (один из октантов на рис. 2.4, а выделен штриховыми линиями). Причем заполненные и незаполненные октанты чередуются в шахматном порядке: рядом с заполненным октантом — незаполненный, под незаполненным — заполненный и т. д.
Решетку алмаза можно представить как две ГЦК-решегки, вставленные одна в другую со смещением на четверть телесной диагонали кубической ячейки. Решетка алмаза не относится к числу плотноупакованных решеток, ее коэффициент компактности равен 0,34.
Отличие элементарных ячеек решеток сфалерита и алмаза состоит в том, что в алмазе все атомы одинаковы, а в сфалерите атомы одного сорта (например, галлия) занимают узлы ГЦК-ячейки, а атомы другого сорта (например, фосфора) — центры четырех октантов.
Весьма распространены в природе также химические соединения со структурой каменной соли NaCl (рис. 2.5). Структуру типа NaCl можно описать как две ГЦК-решетки, вставленные в друг друга так, что вершины ячеек структуры А расположены в центрах ребер ячеек структуры В. При этом кристаллическая решетка состоит из равных количеств разноименно заряженных атомов-ионов (например, Na H и С1
Рис. 2.5. Кристаллическая структура каменной соли: а — схема, б — модель упаковки атомов
Структуру типа NaCl имеют все галогениды щелочных металлов (за исключением CsCl, CsBr и Csl), многие сульфиды, селениды и теллуриды магния, кальция, стронция, бария, свинца, марганца, оксиды переходных элементов TiO, MnO, FeO, MgO, карбиды и нитриды некоторых переходных металлов, например TiC, TiN, ТаС, ZrC, ZrN, UN, UC, галоиды серебра AgCI, AgBr, AgF.
Для некоторых кристаллических веществ характерно явление изоморфизма. Это означает, что разные, но близкие по химической природе вещества с близкими значениями атомных радиусов, т. е. расположенные недалеко друг от друга в Периодической таблице, обладают одинаковым типом кристаллической решетки (например, Ag и Au, Ge и Si). Химические соединения также бывают изоморфными, например Сг23 и А123.
Одно и то же вещество при разных температурах может иметь разные кристаллические решетки. Такое явление называется полиморфизмом и характерно как для элементарных веществ, таких как Fe, Ti, Zr и др., так и для химических соединений, например для А123.
Металлы, обладающие полиморфизмом, кристаллизируются в нескольких решетках, например, a-Fe — ОЦК, y-Fe — ГЦК, a-Ti — ГПУ, p-Ti — ОЦК.
Кристаллическое строение металлов. Характерные свойства металлов. Виды кристаллических решеток, дефекты их строения.
Основные сведения о металлах и сплавах
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике.
Причина этого — в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Железный век продолжается. Примерно 9 /10 всех используемых человечеством металлов и сплавов – это сплавы на основе железа. Железа выплавляется в мире примерно в 50 раз больше, чем алюминия, не говоря уже о прочих металлах.
Было время, когда железо на земле ценилось значительно дороже золота. Советский историк Г. Арешян изучал влияние железа на древнюю культуру стран Средиземноморья. Он приводит такую пропорцию: 1 : 160 : 1280 : 6400. Это соотношение стоимостей меди, серебра, золота и железа у древних хеттов.
До настоящего времени основной материальной базой машиностроения служит черная металлургия, производящая стали и чугуны. Эти материалы имеют много положительных качеств и в первую очередь обеспечивают высокую конструкционную прочность деталей машин. Однако эти классические материалы имеют такие недостатки как большая плотность, низкая коррозионная стойкость. Потери от коррозии составляют 20% годового производства стали и чугуна. Поэтому, по данным научных исследований, через 20…40 лет все развитые страны перестроятся на массовое использование металлических сплавов на базе титана, магния, алюминия. Эти легкие и прочные сплавы позволяют в 2-3 раза облегчить станки и машины, в 10 раз уменьшить расходы на ремонт.
Кристаллическое строение металлов. Характерные свойства металлов. Виды кристаллических решеток, дефекты их строения.
Металлы – простые вещества, обладающие в обычных условиях характерными свойствами:
- специфический «металлический» блеск (хорошая отражательная способность и непрозрачность);
- высокая электропроводность;
- высокая теплопроводность;
- пластичность;
- отрицательный температурный коэффициент электропроводности (возрастание электросопротивления с повышением температуры).
Самыми распространенными в природе металлами являются алюминий, железо, кальций, натрий, калий, магний и титан.
Характерные свойства металлов обусловлены строением их атомов.
Из курса физики известно, что атом состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных частичек — электронов. В ядре атома находятся положительно заряженные частицы — протоны. Количество протонов равно количеству окружающих ядро электронов, т. е. атом в целом является электрически нейтральным.
Атом может терять или приобретать электроны. Тогда он превращается в электрически заряженный атом — ион. При избытке электронов ион заряжен отрицательно, при недостатке электронов — положительно.
Принадлежащие атому электроны разделяют на валентные (внешние), движущиеся по внешним орбитам, и внутренние, движущиеся по более близким к ядру орбитам.
Благодаря слабой связи внешних электронов с ядром в металлах всегда имеются электроны, подвергающиеся воздействию положительно заряженных ядер близлежащих атомов. Такие электроны называются свободными. Свободные электроны принадлежат не одному какому-либо ядру, а блуждают по всему металлу, вращаясь вокруг ядра то одного, то другого иона.
Наличием большого количества свободных электронов (называемых также коллективными или «электронный газ») и объясняются указанные выше характерные признаки металлов.
В отличие от металлов неметаллы, как правило, хрупки, лишены металлического блеска, имеют низкую тепло- и электропроводность. Электросопротивление неметаллов с повышением температуры понижается.
Все металлы в нормальных условиях являются твёрдыми телами (за исключением ртути) и представляют собой вещества, состоящие из большого числа мелких зёрен – кристаллов, упорядоченно расположенных друг относительно друга в пространстве. Этот порядок определяется понятием кристаллическая решётка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Основными типами кристаллических решёток являются:
1) Объемно — центрированная кубическая (ОЦК) (см. рис.1 а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Feα)
2) Гранецентрированная кубическая (ГЦК) (см. рис. 1 б), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Cu, Al, Ag, Au, Feγ)
3) Гексагональная, в основании которой лежит шестиугольник:
простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
Рисунок 1 — Основные типы кристаллических решеток: а – объемно-центрированная кубическая;
б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропиейили полиморфизмом.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe): t 1539°С – ОЦК — Feσ.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
В кристаллической решетке реальных металлов имеются различные дефекты (несовершенства), которые нарушают связи между атомами и оказывают влияние на свойства металлов. Различают точечные, линейные и поверхностные дефекты.
Одним из распространенных несовершенств кристаллического строения является наличие точечных дефектов: вакансий, дислоцированных атомов и примесей (рис. 2).
Рисунок 2 — Точечные дефекты
Вакансия – отсутствие атомов в узлах кристаллической решетки.
Дислоцированный атом – это атом, вышедший из узла решетки и занявший место в междоузлие.
Примесные атомы всегда присутствуют в металле, так как практически невозможно выплавить химически чистый металл. Они могут иметь размеры больше или меньше размеров основных атомов и располагаются в узлах решетки или междоузлиях.
Точечные дефекты вызывают незначительные искажения решетки, что может привести к изменению свойств тела (электропроводность, магнитные свойства), их наличие способствует процессам диффузии и протеканию фазовых превращений в твердом состоянии. При перемещении по материалу дефекты могут взаимодействовать.
Основными линейными дефектами являются дислокации.
Д ислокация – это дефекты кристаллического строения, представляющие собой линии, вдоль и вблизи которых нарушено характерное для кристалла правильное расположение атомных плоскостей. Простейшие виды дислокаций – краевые и винтовые.
Рисунок 3 — Искажения в кристаллической решетке при наличии краевой дислокации
Плотность дислокации в значительной мере определяет пластичность и прочность материала. С увеличением плотности дислокаций возрастает внутреннее механическое напряжение, изменяются оптические свойства, повышается электросопротивление металла. Дислокации ускоряют старение и другие процессы, уменьшают химическую стойкость, поэтому в результате обработки поверхности кристалла специальными веществами в местах выхода дислокаций образуются ямки.
Дата добавления: 2015-11-20 ; просмотров: 4854 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Кристаллические решетки. Типы кристаллических решеток.
Большинство твердых веществ имеют кристаллическую структуру, в которой частицы, из которых она «построена» находятся в определенном порядке, создавая тем самым кристаллическую решетку. Она строится из повторяющихся одинаковых структурных единиц — элементарных ячеек, которая связывается с соседними ячейками, образуя дополнительные узлы. В результате существует 14 различных кристаллических решеток.
Типы кристаллических решеток.
В зависимости от частиц, которые стоят в узлах решетки, различают:
- металлическую кристаллическую решетку;
- ионную кристаллическую решетку;
- молекулярную кристаллическую решетку;
- макромолекулярную (атомную) кристаллическую решетку.
Металлическая связь в кристаллических решетках.
Атомы расположены максимально близко друг к другу, очень плотно. Промежутки между атомами (шарами) очень малы, поэтому имеет место быть название, плотноупакованная структура. Существует 3 основных типа таких структур: гексагональная плотная упаковка (ГПУ), гранецентрированная кубическая упаковка (ГКУ) и объемно центрированная кубическая упаковка (ОЦКУ). Последняя менее плотная.
Как «упаковывается» один слой кристаллической решетки?
Гексагональная кристаллическая решетка
Каждый шар соприкасается с 6-ю соседними шарами, центры любых соседних атомов образуют равносторонний треугольник.
Квадратная кристаллическая решетка
Центры соседних шаров образуют квадрат.
Как «упаковываются» слои кристаллической решетки?
Представим, есть слои А и В. При гексагональной упаковке слои можно укладывать несколькими способами, и при этом образуется гексагональная плотная упаковка или гранецентрированная кубическая упаковка. Соблюдается условие: каждый шар верхнего слоя касается 3х шаров нижнего. Шары 3го слоя расположены четко над шарами 1го слоя, шары 4го – над 2ыми и т.д.
Более сложное строение имеет гексагональная кубическая упаковка (ГКУ) – шары 3го слоя находятся над промежутками 2го слоя, и поэтому слои С и А имеют существенные различия.
Объемно центрированная кубическая упаковка складывается только одним способом: каждый шар находится в центре куба, вершины которого заняты другими шарами, т.е. каждый шар касается 8-ми соседних, при этом принято говорить о том, что каждый атом имеет координационное число, равное 8.
Гексагональная плотная упаковка
Гранецентрированная кубическая упаковка
Объемно центрированная кубическая упаковка
Если говорить о координационных числах гранецентрированная кубическая упаковка и гексагональная плотная упаковка, то оно равно 12.
В пространстве можно эти типы упаковок представить так:
Гексагональная плотная упаковка
Гранецентрированная кубическая упаковка
Объемно центрированная кубическая упаковка
Примеры кристаллических решеток.
Вещества с металлической структурой обладают такими свойствами, как температура плавления, кипения, ковкость, плотность, теплопроводность и электропроводность.
Ионная связь кристаллических решеток.
В узлах кристалла находятся ионы, из-за этого тут превалируют электростатические силы, вследствие чего в структуре должна быть электрическую нейтральность. У каждого типа ионной решетки должно быть свое координационное число. Например, молекула хлорида натрия: Na + , Cl — . Каждый ион Na + окружен 6-тью ионами Cl — , поэтому координационное число равно 6. И вокруг иона Cl — тоже 6 ионов натрия, поэтому тут в молекуле присутствует координация 6:6.
Рассмотрим другой пример, хлорид цезия CsCl. Ион цезия большой, по сравнению с ионом натрия, поэтому его окружает уже не 6 Cl–ионов, а 8. Поэтому координационное число равно 8.
Вещества с таким типом решетки обладают высокой твердостью, они тугоплавки и малолетучи. Электричество проводят не только растворы, но и расплавы (т.к. ионные соединения диссоциируют в полярных жидкостях (вода).
Ионные кристаллы обладают повышенной хрупкостью, т.к. сдвиг в решетке кристалла (даже незначительный) приводит к тому, что одноименно заряженные ионы начинают отталкиваться друг от друга, и связи рвутся, образуются трещины и расколы.
Молекулярная связь кристаллических решеток.
Основная особенность межмолекулярной связи заключается в ее «слабости» (ван-дер-ваальсовые, водородные).
Это структура льда. Каждая молекула воды связана водородными связями с 4-мя окружающими ее молекулами, в результате структура имеет тетраэдрический характер.
Водородная связь объясняет высокую температуру кипения, плавления и малую плотность;
Макромолекулярная связь кристаллических решеток.
В узлах кристаллической решетки находятся атомы. Эти кристаллы разделяются на 3 вида:
- каркасные;
- цепочечные;
- слоистые структуры.
Каркасной структурой обладает алмаз – одно их самых твердых веществ в природе. Атом углерода образует 4 одинаковые ковалентные связи, что говорит о форме правильного тетраэдра (sp 3 – гибридизация). Каждый атом имеет неподеленную пару электронов, которые также могут связываться с соседними атомами. В результате чего образуется трехмерная решетка, в узлах которой только атомы углерода.
Энергии для разрушения такой структуры требуется очень много, температура плавления таких соединений высока (у алмаза она составляет 3500°С).
Слоистые структуры говорят о наличии ковалентных связях внутри каждого слоя и слабых ван-дер-ваальсовых — между слоями.
Рассмотрим пример: графит. Каждый атом углерода находится в sp 2 — гибридизации. 4-ый неспаренный электрон образует ван-дер-ваальсовую связь между слоями. Поэтому 4ый слой очень подвижен:
Связи слабые, поэтому их легко разорвать, что можно наблюдать у карандаша – «пишущее свойство» — 4ый слой остается на бумаге.
Графит – отличный проводник электрического тока (электроны способны перемещаться вдоль плоскости слоя).
Цепочечными структурами обладают оксиды (например, SO3), который кристаллизуется в виде блестящих иголок, полимеры, некоторые аморфные вещества, силикаты (асбест).
2.3. Типы кристаллических решеток
Идеальную кристаллическую решетку можно построить путем многократного повторения с последовательной трансляцией (переносом в пространстве) в трех направлениях кристаллических элементарных ячеек, которые являются первичными звеньями кристаллической решетки.
Элементарная ячейка — это наименьший объем кристалла, который еще передает характерные особенности кристаллической решетки. Элементарная кристаллическая ячейка представляет собой элементарный параллелепипед, ребра которого принимают за оси координат кристалла (х, у, z), а наименьшие расстояния между узлами кристаллической решетки (стороны элементарного параллелепипеда) вдоль осей х, у, z обозначаются соответственно а, Ь, с и называются параметрами, или периодами, решетки. Если кристаллическая решетка кубическая, то ее параметры (периоды) вдоль всех трех осей равны, т. е. а = b = с. Геометрически возможно существование 14 типов кристаллических решеток.
По расположению атомов в элементарной ячейке кристаллические решетки подразделяют на простые и сложные.
В простых (примитивных) решетках атомы располагаются только по вершинам ячейки, т. е. на долю каждой из них приходится один атом.
Сложными являются решетки, в которых на долю каждой ячейки приходится более одного атома. Среди них наиболее часто встречаются следующие тетрагональные решетки:
- • объемноцентрированные, в которых атомы располагаются в вершинах и в центре параллелепипеда;
- • гранецентрированные — решетки с атомами, расположенными в вершинах и центрах всех граней параллелепипеда;
- • базоцентрированные, имеющие атомы в вершинах и центрах противоположных граней параллелепипеда.
Существуют также решетки с гексагональной симметрией.
Для промышленных металлов наиболее распространенными являются следующие типы кристаллических решеток (рис. 2.2):
- • кубическая объемноцентрированная (ОЦК-решетка, рис. 2.2, а) (координационное число — число ближайших к данному соседних атомов — равно 8): V, Nb, Сг, Та, Mo, W, a-Fe (при t 882 °С), p-Zr (при t > 862 °С), р-Вс (при t > 1254 *С) и др.;
- • кубическая гранецентрированная (ЩК-решетка, рис. 2.2, б) (координационное число равно 12): Al, Си, Pt, Pb, Ag, Аи, Ni, р-Со (при t > 400 °С), y-Fe (при t = 911-1392 °С), Pd и др.;
- • гексагональная плотноупакованная (ГПУ-решетка, рис. 2.2, в) (координационное число равно 12): Mg, Zn, Hf, Re, a-Ti (при t
Рис. 2.2. Типы наиболее распространенных кристаллических решеток металлов и схемы упаковки атомов: а — объемноцентрированная кубическая, б — гранецентрированная кубическая, в — гексагональная плотноупакованная; показаны индексы некоторых направлений и плоскостей (индицируемые плоскости заштрихованы); а, с — параметры решетки. Пояснения к индицированию плоскостей и направлений см. в разд. 2.4 и 2.5
ГЦК- и ГПУ-решетки являются плогноупакованными, имеют наивысший коэффициент компактности (отношение объема, занимаемого атомами в элементарной ячейке, к ее полному объему), равный 0,74. У ОЦК-решетки коэффициент компактности составляет 0,68. Таким образом, оставшаяся часть объема элементарной ячейки приходится на пустоты между атомами. Различают два типа пустот — октаэдрические и тетраэдрические. Каждая октаэдрическая пустота расположена между шестью атомами решетки, занимающими места в вершинах правильного октаэдра. Каждая тетраэдрическая — между четырьмя атомами решетки, занимающими места в вершинах правильного тетраэдра. На рисунке 2.3 показано положение тетраэдрических и октаэдрических пустот в ГЦК-, ГПУ- и ОЦК-решетках.
Рис. 2.3. Октаэдрические (о) и тетраэдрические (х) пустоты в ГЦК- (а, б),
ГПУ- (в, г) и ОЦК- (д, е) решетках; • — узловые атомы решетки
В октаэдрическую пустоту и ГЦК-, и ГПУ-решетки можно вписать сферу радиусом 0,41 /?, в тетраэдрическую пустоту — 0,22/?, где R — радиус узлового атома решетки. В октаэдрическую пустоту ОЦК-решетки можно вписать сферу радиусом 0,15/?, в тетраэдрическую — 0,29/?.
Заметим, что на каждый атом как ГЦК-, так и ГПУ-решетки приходятся две тетраэдрические и одна октаэдрическая пустота, а на каждый атом ОЦК-решетки — три октаэдрические и шесть тетраэдрических пустот.
Примечательно, что примесные атомы внедрения в ОЦК-решетке (например, углерод, азот в a-железе) могут легко размещаться в меньших по размеру тетраэдрических пустотах, поскольку вокруг октаэдрической пустоты при этом смещаются лишь два узловых атома вдоль ребра куба, т. е. вдоль направления с малой плотностью упаковки атомов. А вокруг тетраэдрической пустоты при внедрении в нее атома примеси смещаются четыре узловых атома в направлениях довольно плотной упаковки. Эта ситуация будет обсуждена ниже (разд. 2.15) при рассмотрении образования атмосфер Снука вокруг дислокаций.
Важнейшие элементарные полупроводники, такие как кремний и германий, имеют кристаллическую структуру типа алмаза, а многие полупроводниковые соединения типа А 2 В 6 или А 3 В 5 (например, CdS, CdTe, GaAs, GaP, InSb, InP, A1P, AlSb, a-ZnS и др.) — структуру типа сфалерита. В этих решетках каждый атом окружен четырьмя соседними, расположенными в вершинах правильного тетраэдра (координационное число равно 4).
На рисунке 2.4 показаны кристаллические решетки алмаза и сфалерита.
Рис. 2.4. Кристаллические решетки алмаза (а) и сфалерита (б)
В решетке алмаза атомы занимают все узлы ГЦК-ячейки, а также центры четырех из восьми октантов, на которые можно мысленно разбить куб (один из октантов на рис. 2.4, а выделен штриховыми линиями). Причем заполненные и незаполненные октанты чередуются в шахматном порядке: рядом с заполненным октантом — незаполненный, под незаполненным — заполненный и т. д.
Решетку алмаза можно представить как две ГЦК-решегки, вставленные одна в другую со смещением на четверть телесной диагонали кубической ячейки. Решетка алмаза не относится к числу плотноупакованных решеток, ее коэффициент компактности равен 0,34.
Отличие элементарных ячеек решеток сфалерита и алмаза состоит в том, что в алмазе все атомы одинаковы, а в сфалерите атомы одного сорта (например, галлия) занимают узлы ГЦК-ячейки, а атомы другого сорта (например, фосфора) — центры четырех октантов.
Весьма распространены в природе также химические соединения со структурой каменной соли NaCl (рис. 2.5). Структуру типа NaCl можно описать как две ГЦК-решетки, вставленные в друг друга так, что вершины ячеек структуры А расположены в центрах ребер ячеек структуры В. При этом кристаллическая решетка состоит из равных количеств разноименно заряженных атомов-ионов (например, Na H и С1
Рис. 2.5. Кристаллическая структура каменной соли: а — схема, б — модель упаковки атомов
Структуру типа NaCl имеют все галогениды щелочных металлов (за исключением CsCl, CsBr и Csl), многие сульфиды, селениды и теллуриды магния, кальция, стронция, бария, свинца, марганца, оксиды переходных элементов TiO, MnO, FeO, MgO, карбиды и нитриды некоторых переходных металлов, например TiC, TiN, ТаС, ZrC, ZrN, UN, UC, галоиды серебра AgCI, AgBr, AgF.
Для некоторых кристаллических веществ характерно явление изоморфизма. Это означает, что разные, но близкие по химической природе вещества с близкими значениями атомных радиусов, т. е. расположенные недалеко друг от друга в Периодической таблице, обладают одинаковым типом кристаллической решетки (например, Ag и Au, Ge и Si). Химические соединения также бывают изоморфными, например Сг23 и А123.
Одно и то же вещество при разных температурах может иметь разные кристаллические решетки. Такое явление называется полиморфизмом и характерно как для элементарных веществ, таких как Fe, Ti, Zr и др., так и для химических соединений, например для А123.
Металлы, обладающие полиморфизмом, кристаллизируются в нескольких решетках, например, a-Fe — ОЦК, y-Fe — ГЦК, a-Ti — ГПУ, p-Ti — ОЦК.
Типы кристаллических решеток
Класс: 8
Презентация к уроку
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Тип урока: Комбинированный.
Цель урока: Создать условия для формирования умения учащихся устанавливать причинно-следственную зависимость физических свойств веществ от вида химической связи и типа кристаллической решетки, предсказывать тип кристаллической решетки на основе физических свойств вещества.
Задачи урока:
- Сформировать понятия о кристаллическом и аморфном состоянии твердых тел, ознакомить учащихся с различными типами кристаллических решеток, установить зависимость физических свойств кристалла от характера химической связи в кристалле и типа кристаллической решетки, дать учащимся основные представления о влиянии природы химической связи и типов кристаллических решеток на свойства вещества.
- Продолжить формирование мировоззрения учащихся, рассмотреть взаимное влияние компонентов целого-структурных частиц веществ, в результате которого появляются новые свойства, воспитывать умения организовать свой учебный труд, соблюдать правила работы в коллективе.
- Развивать познавательный интерес школьников, используя проблемные ситуации;
Оборудование: Периодическая система Д.И. Менделеева, коллекция «Металлы», неметаллы: сера, графит, красный фосфор, кристаллический кремний, йод; Презентация «Типы кристаллических решёток», модели кристаллических решеток разных типов (поваренной соли, алмаза и графита, углекислого газа и йода, металлов), образцы пластмасс и изделий из них, стекло, пластилин, компьютер, проектор.
Ход урока
1. Организационный момент.
Учитель приветствует учеников, фиксирует отсутствующих.
2. Проверка знаний по темам” Химическая связь. Степень окисления”.
Самостоятельная работа (15 минут)
3. Изучение нового материала.
Учитель озвучивает тему урока и цель урока. (Слайд 1,2)
Учащиеся записывают в тетради дату, тему урок.
Актуализация знаний.
Учитель задаёт вопросы классу:
- Какие виды частиц вы знаете? Имеют ли заряды ионы, атомы и молекулы?
- Какие виды химических связей вы знаете?
- Какие вам известны агрегатные состояния веществ?
Учитель: «Любое вещество может быть газом, жидкостью и твёрдым веществом. Например, вода. При обычных условиях – это жидкость, но она может быть паром и льдом. Или кислород при обычных условиях представляет собой газ, при температуре -1940 C он превращается в жидкость голубого цвета, а при температуре -218,8°C затвердевает в снегообразную массу, состоящую из кристаллов синего цвета. На этом уроке мы рассмотрим твёрдое состояние веществ: аморфное и кристаллическое». (Слайд 3)
Учитель: аморфные вещества не имеют чёткой температуры плавления – при нагревании они постепенно размягчаются и переходят в текучее состояние. К аморфным веществам относят, например шоколад, который тает и в руках и во рту; жевательную резинку, пластилин, воск, пластмассы (показываются примеры таких веществ). (Слайд 7)
Кристаллические вещества имеют чёткую температуру плавления и, главное, характеризуются правильным расположением частиц в строго определенных точках пространства. (Слайды 5,6) При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решёткой. Точки, в которых размещены частицы кристалла, называют узлами решётки.
Учащиеся записывают в тетрадь определение: «Кристаллической решёткой называют совокупность точек пространства, в которых располагаются частицы, образующие кристалл. Точки, в которых размещаются частицы кристалла, называют узлами решётки».
В зависимости от того, какие виды частиц находятся в узлах этой решётки, различают 4 типа решёток. (Слайд 8) Если в узлах кристаллической решётки находятся ионы, то такая решётка называется ионной.
Учитель задаёт учащимся вопросы:
– Как будут называться кристаллические решётки, в узлах которых находятся атомы, молекулы?
Но есть кристаллические решётки, в узлах которых находятся и атомы, и ионы. Такие решётки называются металлическими.
Сейчас мы будем заполнять таблицу: «Кристаллические решётки, вид связи и свойства веществ». В ходе заполнения таблицы мы будем устанавливать взаимосвязь между типом решётки, видом связи между частицами и физическими свойствами твёрдых веществ.
Далее на экране появляется таблица. (Слайд 9). Её заполнение идёт в ходе диалога учителя с учащимися.
Рассмотрим 1-й тип кристаллической решётки, которая называется ионной. (Слайд 9)
– Какие частицы располагаются в узлах этой решётки?
– Какая химическая связь в этих веществах?
Посмотрите на ионную кристаллическую решётку (показывается модель такой решётки). В её узлах находятся положительно и отрицательно заряженные ионы. Например, кристалл хлорида натрия построен из положительных ионов натрия и отрицательных хлорид-ионов, образующих решётку в форме куба. К веществам с ионной кристаллической решёткой относятся соли, оксиды и гидроксиды типичных металлов. Вещества с ионной кристаллической решёткой обладают высокой твёрдостью и прочностью, они тугоплавкие и нелетучие.
Учитель: Физические свойства веществ с атомной кристаллической решёткой те же, что и у веществ с ионной кристаллической решёткой, но часто в превосходной степени – очень твёрдые, очень прочные. Алмаз, у которого атомная кристаллическая решётка – самое твёрдое вещество из всех природных веществ. Он служит эталоном твёрдости, которая по 10-бальной системе оценивается высшим баллом 10.(Слайд 10). По этому типу кристаллической решётки вы сами внесёте необходимые сведения в таблицу, самостоятельно поработав с учебником.
Учитель: Рассмотрим 3-й тип кристаллической решётки, которая называется металлической. (Слайды 11,12) В узлах такой решётки находятся атомы и ионы, между которыми свободно перемещаются электроны, связывая их в единое целое.
Далее учащиеся по учебнику рассматривают модель металлической кристаллической решётки.
Такое внутреннее строение металлов и определяет их характерные физические свойства.
Учитель: Какие физические свойства металлов вы знаете? (ковкость, пластичность, электро- и теплопроводность, металлический блеск).
Учитель: На какие группы делятся все вещества по строению? (Слайд 12)
Рассмотрим тип кристаллической решётки, которой обладают такие хорошо известные нам вещества как вода, углекислый газ, кислород, азот и другие. Она называется молекулярной. (Слайд14)
– Какие частицы располагаются в узлах этой решётки?
Далее учащиеся по учебнику рассматривают модель молекулярной кристаллической решётки.
Химическая связь в молекулах, которые находятся в узлах решётки, может быть и ковалентная полярная, и ковалентная неполярная. Несмотря на то, что атомы внутри молекулы связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярной кристаллической решёткой имеют малую твердость, низкие температуры плавления и летучие. Когда газообразные или жидкие вещества при особых условиях превращаются в твёрдые, тогда у них появляется молекулярная кристаллическая решётка. Примерами таких веществ может быть твёрдая вода – лёд, твёрдый углекислый газ – сухой лёд. Такую решётку имеет нафталин, который применяют для защиты шерстяных изделий от моли.
– Какими свойствами молекулярной кристаллической решётки обусловлено применение нафталина? (летучестью). Как видим, молекулярную кристаллическую решетку могут иметь не только твердые простые вещества: благородные газы, H2,O2, N2, I2, O3, белый фосфор Р4, но и сложные: твердая вода, твердые хлороводород и сероводород. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза,сахар).
В узлах решеток находятся неполярные или полярные молекулы. Несмотря на то, что атомы внутри молекул связаны прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия.
Вывод: Вещества непрочные, имеют малую твердость, низкую температуру плавления, летучи.
Вопрос: Какой процесс называется возгонкой или сублимацией?
Ответ: Переход вещества из твердого агрегатного состояния сразу в газообразное, минуя жидкое, называется возгонкой или сублимацией.
Демонстрация опыта: возгонка йода
Потом учащиеся по очереди называют сведения, которые они записали в таблицу.
Кристаллические решетки, вид связи и свойства веществ.